
����Ŀ��[��ѧ����ѡ��3�����ʽṹ������]
ԭ���������������A��B��C��D��E��F����Ԫ�ء�����A�Ļ�̬ԭ����3����ͬ���ܼ������ܼ��еĵ�������ȣ�C�Ļ�̬ԭ��2p�ܼ��ϵ�δ�ɶԵ�������Aԭ�ӵ���ͬ��DΪ������������ԭ�Ӱ뾶��������Ԫ�أ�E��Cλ��ͬһ���壬F��ԭ������Ϊ29��
��1��F��̬ԭ�ӵĺ�������Ų�ʽΪ______________________��
��2����A��B��C����Ԫ���У���һ��������С�����˳����___________����Ԫ�ط��Żش𣩡�
��3��Ԫ��B�ļ���̬�⻯��ķе�___________������������������������Ԫ��A�ļ���̬�⻯��ķе㣬����Ҫԭ����______________________��
��4����A��B��C�γɵ�����CAB��AC2��Ϊ�ȵ����壬��CAB�ĽṹʽΪ___________��
��5����Ԫ��A��E���γɵij����������У�Aԭ�ӹ�����ӻ�����Ϊ___________��
��6����B��C��D����Ԫ���γɵĻ����ᄃ��ľ�����ͼ��ʾ����û�����Ļ�ѧʽΪ___________��

��7��FC�ڼ�������������ת��ΪF2C����ԭ�ӽṹ�ĽǶȽ���ԭ��______________________��
���𰸡� 1s22s22p63s23p63d104s1��[Ar]3d104s1 C<O<N ���� NH3����֮������������CH4���Ӽ�������Ƿ��»���������ȷ��»�����ǿ [N=C=O] sp NaNO2 Cu+��Χ����3d10���ȫ�����ȶ���Cu2+��Χ����3d9������ӷ�ȫ����״̬���ȶ�
��������A�Ļ�̬ԭ����3����ͬ���ܼ������ܼ��еĵ�������ȣ����A�ĺ�������Ų�ʽΪ1s22s22p2����AΪC��C�Ļ�̬ԭ��2p�ܼ��ϵ�δ�ɶԵ�������Aԭ�ӵ���ͬ����CΪO����BΪN��E��Cλ��ͬһ���壬��EΪS��DΪ����������ԭ�Ӱ뾶��������Ԫ�أ���DΪNa��F��ԭ������Ϊ29����FΪCu����1��FΪds������˺�������Ų�ʽΪ��1s22s22p63s23p63d104s1��[Ar]3d104s1����2��ͬ���ڴ������ҵ�һ����������IIA>IIIA��VA>VIA����һ�����ܴ�С˳����N>O>C����3��B���⻯����NH3��A�ļ��⻯����CH4��NH3����֮������������CH4���Ӽ�������Ƿ��»���������ȷ��»�����ǿ����4��CAB���Ļ�ѧʽΪOCN����AC2�Ļ�ѧʽΪCO2������Ϊ�ȵ����壬���ǵĽṹ���ƣ����OCN���ĽṹʽΪ��[N=C=O] ����5���γɵĻ�������CS2���ṹʽΪS=C=S���ӻ���������ڼ۲���Ӷ�������C���ӻ�����Ϊsp����6�����ݰ뾶��С���������Na�������λ�ھ��������ϣ�����������ھ����ĸ���Ϊ8��1/4=2�������ΪN��С����ΪO�������γ�������NO2������λ�ڶ�������ģ������ĸ���Ϊ8��1/8=1=2����˻�ѧʽΪNaNO2����7��FCΪCuO��F2CΪCu2O��Cu�ĺ�������Ų�ʽ1s22s22p63s23p63d104s1��Cu2���ĵ����Ų�ʽΪ1s22s22p63s23p63d9��Cu���ĵ����Ų�ʽΪ1s22s22p63s23p63d10�����ݺ��ع����ڰ�����ȫ����ȫ�գ�����ȶ���ԭ����Cu+��Χ����3d10���ȫ�����ȶ���Cu2+��Χ����3d9������ӷ�ȫ����״̬���ȶ���


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±�ΪԪ�����ڱ���һ���֡�
̼ | �� | Y | |
X | �� | Z |
����˵������ȷ����
A. �ǽ����ԣ�Y����
B. ���Ӱ뾶��Y2-��S2-��Z-
C. ���������ԣ�Z���ʣ�����
D. ZԪ�������ڱ���λ�ڵ������ڵڢ�A��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��龧���У���ѧ����������ͬ��
A. SO2��MgO B. NaCl��HCl
C. CO2��H2O D. CCl4��KCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪NAΪ�����ӵ���������ֵ������˵����ȷ����
A. 25��ʱ��pH=13��1.0LBa(OH)2��Һ�к��е�OH-��ĿΪ0.2NA
B. һ�����������ܱ�������2 molSO2��2 molO2��ַ�Ӧ�����յ����������Ϊ3NA
C. ��lmolNH4NO3����ϡ��ˮ��ʹ��Һ�����ԣ���Һ��NH4+��ĿΪNA
D. 4.6g�Ҵ����й��ۼ�����ĿΪ0.9NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��NO2�����������Ǻ���ɫ���壬�Ҷ���ǿ�����ԡ��ڼ�ѹ�����£�NO2���Է������·�Ӧ��2NO2(g)![]() N2O4(g)�������Լ����в��ܽ�NO2��������������(����)
N2O4(g)�������Լ����в��ܽ�NO2��������������(����)
A. �����������м�������ˮ����
B. ����������ֱ�ͨ��AgNO3��Һ��
C. ��ʪ��ĵ���KI��ֽ����
D. �����������ѹ����ȴ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����û�ѧ��Ӧԭ��֪ʶ�ش������й�̼��̼�Ļ���������}
������β������Ҫ��Ⱦ����NO�Լ�ȼ��ȼ�ղ���ȫ��������CO���������ִ������е���Ҫ������Ⱦ�Ϊ�˼�������β����ɵĴ�����Ⱦ�����ǿ�ʼ̽������NO��CO��һ��������ת��Ϊ����������E��F�ķ�������֪�÷�Ӧ��һ�������¿����Է����У�����2L�ܱ������м���һ����NO��CO�����ضȷֱ���T1��T2ʱ����ø�����ƽ��ʱ���ʵ������±���
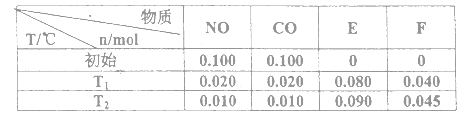
�������ϱ����ݣ�д��NO��CO��Ӧ�Ļ�ѧ����ʽ___________________���÷�Ӧ�ġ�S_______0 (�<����>��)��
��������ӦT1��ʱ��ƽ�ⳣ��ΪK1��T2��ʱ��ƽ�ⳣ��ΪK2�����ݱ������ݼ���K1=_________�����ݱ��������жϣ��¶�T1��T2��ϵ�ǣ�����ţ�______________��
A. T1>T2 B. T1<T2 C.���Ƚ�
(2)���ɵ�CO2�������������������գ�����0.4molCO2,����200mL3mol/LNaOH��Һ������ȫ���գ���Һ������Ũ���ɴ�С��˳��Ϊ____________��
(3)CO2����Ȼ��ѭ��ʱ����CaCO3��Ӧ��CaCO3��һ���������ʣ���Ksp=2.8��10-9��CaCl2��Һ��Na2CO3��Һ��Ͽ��γ�CaCO3�������ֽ��������CaCl2��Һ��Na2CO3��Һ��ϣ���Na2CO3��Һ��Ũ��Ϊ2��10-4mol/L�������ɳ�������CaCl2��Һ����СŨ��Ϊ��___________mol/L��(���Ի��ǰ����Һ����ı仯��
(4)��֪14gCO��ȫȼ��ʱ�ų�141.5 kJ ����������д��COȼ���ȵ��Ȼ�ѧ����ʽ��_____________��
(5)CO����������ȼ�ϵ�ص�ȼ�ϣ�ij������ȼ�ϵ�ؾ��иߵķ���Ч�ʣ�����ܵ����ӣ��õ����Li2CO3��Na2CO3�������λ����������ʣ�COΪ����ȼ����������CO2�Ļ����Ϊ������ȼ�����Ƶ���650���¹�����ȼ�ϵ�أ�д���为���������缫��Ӧ����ʽ��������_________��������________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��B��C��D�Ǻ���һ����ͬԪ�ص��������ʣ�����֮��ɷ�������ת����A��B![]() C��D������A�ǵ��ʣ�B��C�������D�dz������ᡣ
C��D������A�ǵ��ʣ�B��C�������D�dz������ᡣ
(1)��A��һ�ֻ�ɫ��ĩ���壬������������⣺
�����������ʵĻ�ѧʽ�ֱ��ǣ�
A_____��B_____��C_____��D_____��
��B��C�Ļ�ѧ��Ӧ����ʽΪ__��
(2)��A��һ�ֳ��������壬������������⣺
�����������ʵĻ�ѧʽ�ֱ��ǣ�
A_____��B��____��C_____��D__________��
��C��B�Ļ�ѧ��Ӧ����ʽΪ__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��13C��NMR ���˴Ź���15N��NMR�����ڲⶨ�����ʡ�������������ӵĿռ�ṹKurtWuthrich ����Ϊ�˻��2002��ŵ������ѧ��������������ȷ���ǣ� ��
A. 13C��15N����ͬ�������� B. 13C��C60��Ϊͬλ��
C. 15N��14N��NԪ�ص�����ͬλ�� D. 15N�ĺ������������������ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Һ�������ճ������бز����٣��������֪ʶ�ش��������⡣
(1)��������Һʱ������ͨ��NaOH��Һ�У�������Ӧ�����ӷ���ʽΪ__��
(2)ȡ��������Һ�μӵ�AgNO3��Һ�У������dz��ְ�ɫ������˵������Һ����____��
(3)����Һϡ�ͺ������ڿ����У�����������Ư���Ե����ʣ���д���˹��̵����ӷ�Ӧ����ʽ��___________��
��������Ư��������Ϊ����ǿ�����ԣ�������Ҳ�ܲ��ȶ�����д�����ֽ�Ļ�ѧ��Ӧ����ʽ��_______________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com