
| ||
| △t |
| ||
| 2min |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 据报道,摩托罗拉公司开发了一种以甲醇为原料,以KOH溶液为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月.右图是一个电化学过程的示意图.
据报道,摩托罗拉公司开发了一种以甲醇为原料,以KOH溶液为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月.右图是一个电化学过程的示意图.| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:

 分别与浓溴水和NaOH溶液完全反应,消耗Br2和NaOH的物质的量分别是
分别与浓溴水和NaOH溶液完全反应,消耗Br2和NaOH的物质的量分别是查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
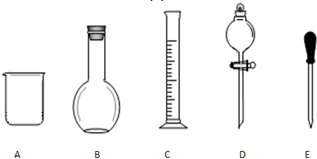 实验室需要0.1mol/L NaOH溶液480mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.
实验室需要0.1mol/L NaOH溶液480mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、[Cu(H2O)4]SO4?H2O |
| B、[Ag(NH3)2]OH |
| C、KAl(SO4)2?12H2O |
| D、Na[Al(OH)4] |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧化钠溶液与盐酸反应:H++OH-=H2O |
| B、铁溶于氯化铁溶液:Fe3++Fe=2Fe2+ |
| C、碳酸钙与盐酸反应:CO32-+2H+=CO2↑+H2O |
| D、钠与水反应:Na+2H2O=Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
| B、3c(Na+)=4[c (H2CO3)+c(HCO3-)+c(CO32-)] |
| C、c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| D、3c(OH-)+2 c(CO32-)=c(HCO3-)+4c(H2CO3)+3c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com