
| A、c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
| B、3c(Na+)=4[c (H2CO3)+c(HCO3-)+c(CO32-)] |
| C、c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| D、3c(OH-)+2 c(CO32-)=c(HCO3-)+4c(H2CO3)+3c(H+) |
| 3.36L |
| 22.4L/mol |
| 3.36L |
| 22.4L/mol |


 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲中反应达到平衡时Q1=Q |
| B、达到平衡时,甲中C的体积分数比乙大 |
| C、达到平衡后,再向乙中加入0.25mol A、0.75mol B和0.5mol C,反应向生成C的方向进行 |
| D、乙中发生的反应热化学方程式为2C(g)?A(g)+3B(g)△H=+Q2 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、相同温度下,不同浓度的同一弱电解质,其电离平衡常数(K)不同 | ||
| B、相同温度下,水的离子积常数就是水的电离平衡常数 | ||
C、由K水解=
| ||
| D、同温同浓度条件下,一元弱酸的电离平衡常数(K)越小,则溶液的pH越小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将Al2(SO4)3溶液蒸干得到Al2(SO4)3固体 |
| B、用广泛pH试纸测得某溶液pH为11.3 |
| C、向纯水通入少量HCl气体,水的电离程度减小,Kw减小 |
| D、向0.1 mol?L-1 CH3COOH溶液中加少量水,溶液中所有离子的浓度都减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、熔融NaCl可以导电,则其溶液是电解质 |
| B、O3既不是电解质又不是非电解质 |
| C、CO2溶于水能导电,但CO2是非电解质 |
| D、BaSO4几乎不导电,是非电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、干冰升华要吸收大量的热,但不是化学反应中的吸热反应 |
| B、酒精常被用做酒精灯和内燃机的燃料,说明酒精燃烧是放热反应 |
| C、人们用氢氧焰焊接或切割金属,主要是利用了氢气和氧气化合时放出的能量 |
| D、常温下不燃烧,加热才能燃烧,说明木炭燃烧是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
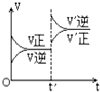 对达到平衡状态的可逆反应:X(?)+Y(?)?W(?)+Z(?)(已配平),在t'时增大压强,则正逆反应速率变化如右图所示(V代表速率,t代表时间.下列有关X、Y、Z、W的状态叙述正确的是( )
对达到平衡状态的可逆反应:X(?)+Y(?)?W(?)+Z(?)(已配平),在t'时增大压强,则正逆反应速率变化如右图所示(V代表速率,t代表时间.下列有关X、Y、Z、W的状态叙述正确的是( )| A、X、Y、W为气体,Z不是气体 |
| B、X、Y为气体,W、Z中有一种是气体 |
| C、W、Z为气体,X、Y中有一种是气体 |
| D、W、Z中有一种为气体,X、Y都不是气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| N2 | H2 | NH3 | |
| ′起始浓度mol/L | 1.0 | 3.0 | 0 |
| 2秒末mol/L | 0.6 | 1.8 | 0.8 |
| A、0.2 | B、0.4 |
| C、0.6 | D、0.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com