
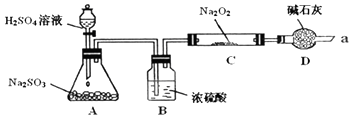
���� A�����Ʊ������������壬B����װ�ã���ȥ���������е�ˮ��������ֹˮ��������Ʒ�Ӧ��Ӱ��ʵ����ۣ�D���������ն�������ֹ��Ⱦ�����������տ����е�ˮ�Ͷ�����̼����ֹ��������Ʒ�Ӧ������Na2O2�ѷ�Ӧ��ȫ��Ϊȷ��C�й������ijɷ��Ƿ�ΪNa2SO4��Ӧ����������Ȼ������飬ע�ⲻ�������ᣬ��ֹ�������Ʊ�����������
����Ũ�������ˮ���Լ��������������Ƶ��������ش�
�������������Ƴ�������3���Ǻ����������ƺ������ƵĻ���
��1���������ƺͶ�������Ӧ���������ƣ�
��2��������������ԣ��ܽ������ᱵ����Ϊ��������������ᱵ��
��3�����ݷ�Ӧǰ��C������6.4g���μӷ�Ӧ��SO2����������Na2O2�������ٸ�����������=$\frac{ʵ������}{������}$��100%���㣮
��� �⣺��Ũ��������ˮ�ԣ������ն��������е�ˮ�֣���ֹˮ������������Ʒ�Ӧ�����Ŷ�������ʯ���Ǹ������������ˮ�֣���ֹˮ�����ĸ��ţ���ʯ���Ǽ������ʣ������ն���������������壬��ֹ��Ⱦ�������ʴ�Ϊ������SO2���壬��ֹˮ������Na2O2��Ӧ����ֹ�����е�ˮ�����Ͷ�����̼����Cװ����Na2O2��Ӧ��ͬʱ���չ�����SO2��������Ⱦ������
�������������Ƴ�������3���Ǻ����������ƺ������ƵĻ����ʴ�Ϊ����Na2SO3��Na2SO4��
��1���������ƺͶ�������Ӧ���������Ƶ�ԭ������ʽΪ��Na2O2+SO2=Na2SO4���ʴ�Ϊ��Na2O2+SO2=Na2SO4��
��2�����ɵİ�ɫ������������������ᱵ����������Ὣ֮����Ϊ���ᱵ�����ܵó����ۣ�������Na2SO4���ʴ�Ϊ����HNO3�������ԣ��ݴ˲���ȷ��������Na2SO3����Na2SO4������У�
��3��������2�������������ƺͶ�������ķ�ӦΪ��Na2O2+SO2=Na2SO4����Ӧǰ��C������6.4g���μӷ�Ӧ��SO2��������μӷ�Ӧ��Na2O2���ʵ�����m��Na2O2��=$\frac{6.4g}{64g/mol}$��78g/mol=7.8g������Na2O2����������Ϊ$\frac{7.8g}{10g}$��100%=78%��
�ʴ�Ϊ��78%��
���� ���⿼�������ʵ�����ʵ����ƣ�Ϊ��Ƶ���㣬������ѧ���ķ��������Ŀ��飬ע�����ʵ���ԭ�����ѶȲ���������и�����Ϣ�������⡢������⣮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
| ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
| SO2 | O2 | SO2 | O2 | |||
| 1 | T1 | 4 | 2 | x | 0.8 | 6 |
| 2 | T2 | 4 | 2 | 0.4 | y | 9 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | 2-������ | B�� | �������ױ� | C�� | ������� | D�� | �Ҷ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1.5 g����-CH3������������ĿΪNA | |
| B�� | 0.1 mol Mg�ڿ�������ȫȼ������MgO��Mg3N2��ת�Ƶĵ�����Ϊ0.2NA | |
| C�� | ��2H��18O����ɵ�ˮ11 g������������������Ϊ5NA | |
| D�� | 1 mol Fe���ڹ������ᣬ����ת����Ϊ2NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ͭ��ϡ���� | B�� | Ba��OH��2��Һ����ϡ������ | ||
| C�� | �����ʯ��ˮ��ϡ���ᷴӦ | D�� | ������������Ʒ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1 L����Һ�к�����98 g | |
| B�� | ��10 mL����Һ��ȡ��5 mL��ʣ����Һ��Ũ�Ȳ��� | |
| C�� | ��4.9 gŨ�������ʢ��50 mL����ˮ���ձ��г���ܽ�Ϳ���ø�Ũ�ȵ�������Һ | |
| D�� | ��Ũ�ȵ�����������ͨ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
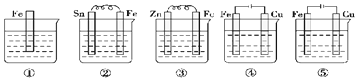
| A�� | �ݢڢ٢ۢ� | B�� | �ۢڢݢܢ� | C�� | �ݢܢۢڢ� | D�� | �ݢڢ٢ܢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ѧ��Ӧ���ʹ�ϵ�ǣ�2������NH3��=3������H2O�� | |
| B�� | �ﵽ��ѧƽ��ʱ��4������O2��=5������NO�� | |
| C�� | �ﵽ��ѧƽ��ʱ�����������������������Ӧ���ʼ�С���淴Ӧ�������� | |
| D�� | ����λʱ��������x mol NO��ͬʱ������x mol NH3����Ӧ�ﵽƽ��״̬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com