
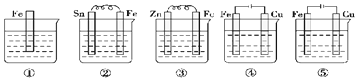
| A. | ⑤②①③④ | B. | ③②⑤④① | C. | ⑤④③②① | D. | ⑤②①④③ |
分析 作原电池负极、电解池阳极的金属被腐蚀,作原电池正极、电解池阴极的金属被保护,且作负极的金属腐蚀速率小于作阳极的金属腐蚀速率,据此分析解答.
解答 解:作原电池负极、电解池阳极的金属被腐蚀,作原电池正极、电解池阴极的金属被保护,且作负极的金属腐蚀速率小于作阳极的金属腐蚀速率,
①中只有一种金属,所以不能构成原电池,正常被腐蚀;
②符合原电池构成条件而构成原电池,铁易失电子而作负极,加速被腐蚀;
③符合原电池构成条件而构成原电池,锌易失电子而作负极,铁作正极,所以铁被保护;
④该装置是电解池,铁连接原电池负极而作阴极,被保护;
⑤该装置是电解池,铁连接原电池正极而作阳极,加速被腐蚀,且腐蚀速率大于铁作负极;
则铁被腐蚀快慢顺序是⑤②①③④,
故选A.
点评 不同条件下金属腐蚀的快慢:电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护腐蚀措施的腐蚀.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
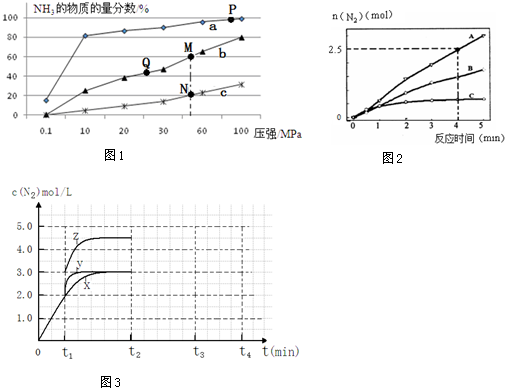
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
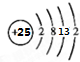 ,其最高正价为+7;是第四周期ⅦB族.
,其最高正价为+7;是第四周期ⅦB族.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
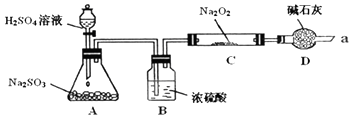
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCl2═Ca2++Cl2 | B. | H2SO4═2 H++SO42- | ||
| C. | Ba(OH)2═Ba++2OH- | D. | NaHCO3═Na++H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 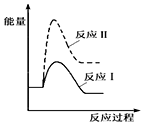 | B. | 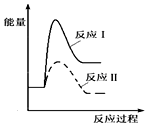 | ||
| C. | 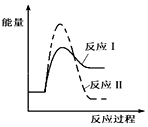 | D. | 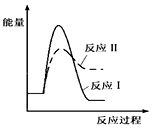 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 26g | B. | 36g | C. | 104g | D. | 37.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com