
| A、所含分子个数相等 |
| B、物质的量相等 |
| C、所含原子个数之比为5:1 |
| D、体积之比为2:1 |
| m |
| M |
| m |
| M |
| m |
| M |
| m |
| M |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、加入铝粉产生H2 的溶液中:Fe2+、Na+、SO2-4、ClO- |
| B、由水电离的c(H+)=1×10-14mol?L-1的溶液中:Ca2+、K+、Cl-、HCO-3 |
| C、c(H+)/c(OH-)=1012的溶液中:NH+4、Al3+、NO-3、Cl- |
| D、使甲基橙呈红色的溶液:K+、Cl-、SO2-4、S2O2-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、断裂1molN≡N键,同时生成6molN-H键 |
| B、V(H2)=V(NH3)=3:2 |
| C、混合气体的密质不再发生改变 |
| D、容器内混合气体的平均相对分子质量不再发生改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将氢氧化铁粉末加入氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O |
| B、向次氯酸钙溶液中通入少量二氧化硫:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO |
| C、向碳酸氢钠溶液中滴加过量的氢氧化钡:2HCO3-+Ba2++2OH-═BaCO3↓+H2O+CO32- |
| D、向溴化亚铁溶液中通入少量氯气:2Fe2++Cl2═2Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.5mol苯分子中含有C=C双键数为1.5NA |
| B、2.8g乙烯、丙烯和聚乙烯的混合物中所含碳原子数为0.2NA |
| C、标准状况下,2.24L C5H12含有的共用电子对为1.6NA |
| D、1mol甲基(-CH3)所含的电子总数为8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol氢的质量是1g |
| B、1mol CO的质量为28g?mol-1 |
| C、2mol O的质量为16g |
| D、3.01×1023个SO2分子的物质的量为0.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
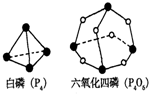 化学反应可视为旧键断裂和新键形成的过程.化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷(P4)和P4O6的分子结构如图所示;现提供以下化学键的键能:P-P 198KJ?mol-1、P-O 360kJ?mol-1、O=O 498kJ?mol-1.则关于1mol P4和3mol O2完全反应(P4+3O2=P4O6)的热效应说法正确的是( )
化学反应可视为旧键断裂和新键形成的过程.化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷(P4)和P4O6的分子结构如图所示;现提供以下化学键的键能:P-P 198KJ?mol-1、P-O 360kJ?mol-1、O=O 498kJ?mol-1.则关于1mol P4和3mol O2完全反应(P4+3O2=P4O6)的热效应说法正确的是( )| A、该反应是吸热反应且吸收热量1638 kJ |
| B、该反应是放热反应且放出热量1638 kJ |
| C、该反应反应物的内能低于产物内能 |
| D、该反应反应物的键能之和高于产物键能之和 |
查看答案和解析>>
科目:高中化学 来源: 题型:
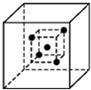 金刚石是由碳原子所形成的正四面体结构向空间无限延伸而得到的具有空间网状结构的原子晶体.在立方体中,若一碳原子位于立方体中心,则与它直接相邻的四个碳原子位于该立方体互不相邻的四个顶角上(如图中的小立方体).请问,图中与小立方体顶角的四个碳原子直接相邻的碳原子数为多少,它们分别位于大立方体的什么位置( )
金刚石是由碳原子所形成的正四面体结构向空间无限延伸而得到的具有空间网状结构的原子晶体.在立方体中,若一碳原子位于立方体中心,则与它直接相邻的四个碳原子位于该立方体互不相邻的四个顶角上(如图中的小立方体).请问,图中与小立方体顶角的四个碳原子直接相邻的碳原子数为多少,它们分别位于大立方体的什么位置( )| A、12,大立方体的12条棱的中点 |
| B、8,大立方体的8个顶角 |
| C、6,大立方体的6个面的中心 |
| D、14,大立方体的8个顶角和6个面的中心 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com