
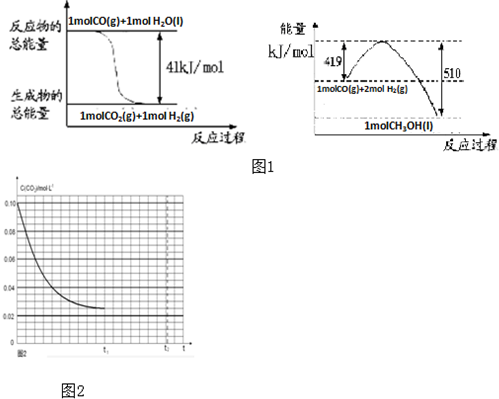
| 1mol×4.0g |
| 50g |
| ||
| 4min |
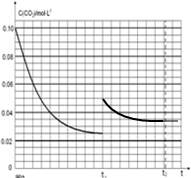 ,
, .
.


科目:高中化学 来源: 题型:
| A、3c-a-b |
| B、a+b-3c |
| C、a+3b-2c |
| D、a+3b-6c |
查看答案和解析>>
科目:高中化学 来源: 题型:
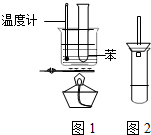 某学生为验证苯的沸点(80.1℃)比水低,设计了如图1所示的实验装置:(某些固定装置已略去)
某学生为验证苯的沸点(80.1℃)比水低,设计了如图1所示的实验装置:(某些固定装置已略去)查看答案和解析>>
科目:高中化学 来源: 题型:
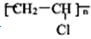 )就是以乙炔为原材料制得的.写出以乙炔和HCl为原料制聚氯乙烯的化学方程式.
)就是以乙炔为原材料制得的.写出以乙炔和HCl为原料制聚氯乙烯的化学方程式.查看答案和解析>>
科目:高中化学 来源: 题型:
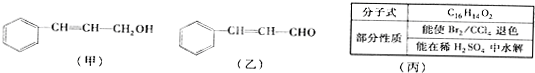
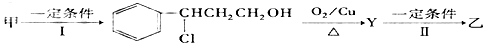
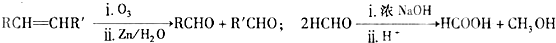
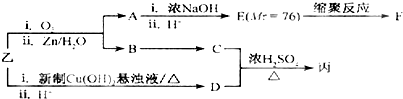
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com