
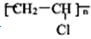 )就是以乙炔为原材料制得的.写出以乙炔和HCl为原料制聚氯乙烯的化学方程式.
)就是以乙炔为原材料制得的.写出以乙炔和HCl为原料制聚氯乙烯的化学方程式.| 催化剂 |
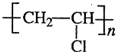 ;
;| 催化剂 |
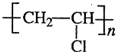 .
.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
| A、0.5mol苯分子中含有C=C双键数为1.5NA |
| B、2.8g乙烯、丙烯和聚乙烯的混合物中所含碳原子数为0.2NA |
| C、标准状况下,2.24L C5H12含有的共用电子对为1.6NA |
| D、1mol甲基(-CH3)所含的电子总数为8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、海底如“土豆”般的金属结核矿含有铁、锰、钴等多种元素,可用铝热法冶炼并分离得到各种金属单质 |
| B、海水淡化工厂可与化工生产结合,如淡化后的浓海水,可用于提溴、镁、钠等 |
| C、海水中的金、铀等元素储量高、浓度低,提炼时,须先富集 |
| D、海水提镁过程中,所需的石灰乳,可用贝壳煅烧后加水得到,体现了就地取材、降低成本的生产理念 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学反应速率:乙>甲 |
| B、平衡后N2的浓度:乙>甲 |
| C、H2的转化率:乙>甲 |
| D、平衡混合气中H2的体积分数:乙>甲 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
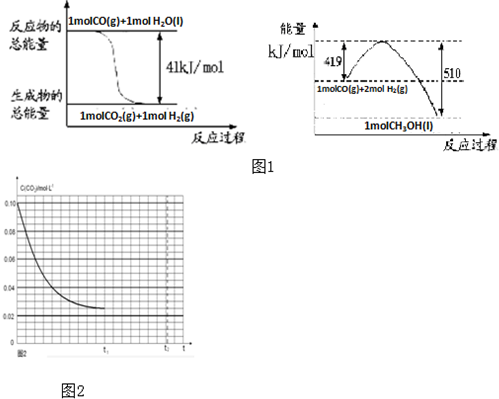
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | ||||||||
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com