
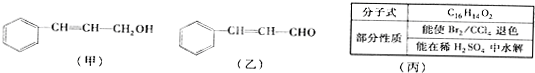
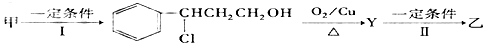
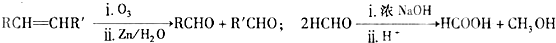
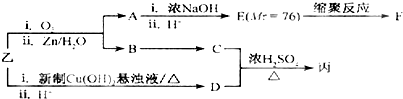
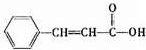 ,则C应为醇,因B为苯甲醛,则C为苯甲醇,故丙为
,则C应为醇,因B为苯甲醛,则C为苯甲醇,故丙为 .E是相对分子质量为76,结合题给信息可知应为OH-CH2-COOH,本身能发生缩聚反应生成F为
.E是相对分子质量为76,结合题给信息可知应为OH-CH2-COOH,本身能发生缩聚反应生成F为 ,以此解答该题.
,以此解答该题. ,
, ;
;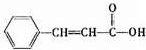 ,则C应为醇,因B为苯甲醛,则C为苯甲醇,故丙为
,则C应为醇,因B为苯甲醛,则C为苯甲醇,故丙为 .E是相对分子质量为76,结合题给信息可知应为OH-CH2-COOH,本身能发生缩聚反应生成F为
.E是相对分子质量为76,结合题给信息可知应为OH-CH2-COOH,本身能发生缩聚反应生成F为 ,
,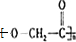 ,故答案为:
,故答案为: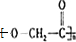 ;
;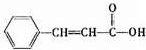 ,满足a.苯环上有两种类型的氢、b. 能发生银镜反应,则含-CHO、且苯环上2个取代基位于对位,则为-CHO、-CH=CHOH或-CH=CHCHO、-OH,HCOO-、-CH=CH2,共有3种,其中一种既能发生银镜反应又能发生水解反应的结构简式为
,满足a.苯环上有两种类型的氢、b. 能发生银镜反应,则含-CHO、且苯环上2个取代基位于对位,则为-CHO、-CH=CHOH或-CH=CHCHO、-OH,HCOO-、-CH=CH2,共有3种,其中一种既能发生银镜反应又能发生水解反应的结构简式为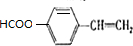 ,
, ;
; ,故答案为:
,故答案为: .
.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
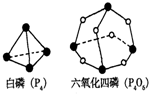 化学反应可视为旧键断裂和新键形成的过程.化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷(P4)和P4O6的分子结构如图所示;现提供以下化学键的键能:P-P 198KJ?mol-1、P-O 360kJ?mol-1、O=O 498kJ?mol-1.则关于1mol P4和3mol O2完全反应(P4+3O2=P4O6)的热效应说法正确的是( )
化学反应可视为旧键断裂和新键形成的过程.化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷(P4)和P4O6的分子结构如图所示;现提供以下化学键的键能:P-P 198KJ?mol-1、P-O 360kJ?mol-1、O=O 498kJ?mol-1.则关于1mol P4和3mol O2完全反应(P4+3O2=P4O6)的热效应说法正确的是( )| A、该反应是吸热反应且吸收热量1638 kJ |
| B、该反应是放热反应且放出热量1638 kJ |
| C、该反应反应物的内能低于产物内能 |
| D、该反应反应物的键能之和高于产物键能之和 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学反应速率:乙>甲 |
| B、平衡后N2的浓度:乙>甲 |
| C、H2的转化率:乙>甲 |
| D、平衡混合气中H2的体积分数:乙>甲 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | ||||||||
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com