
【题目】科研人员设计一种电化学反应器以Na2SO4溶液为电解质,负载纳米MnO2的导电微孔钛膜和不锈钢为电极材料。这种电催化膜反应器可用于正丙醇合成丙酸,装置示意图:

以下叙述错误的是
A. 微孔钛膜作阴极
B. 使用Na2SO4溶液是为了在电解开始时增强溶液导电性
C. 丙醇转化为丙酸的电极反应式为:CH3CH3CH2OH+H2O-4e-=CH3CH2COOH+4H+
D. 反应器工作时料槽中正丙醇分子向电催化膜移动
科目:高中化学 来源: 题型:
【题目】将一定量的铁粉加入100mL稀硫酸中,为中和过量硫酸,且使Fe2+完全转化为Fe(OH)2,共消耗掉2mol·L-1NaOH溶液150mL。原硫酸溶液的浓度是
A. 0.5mol·L-1 B. 1mol·L-1 C. 1.5mol·L-1 D. 2mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 测定HCl和NaOH中和反应的反应热时,单次实验均应测量3个温度,即盐酸起始温度、NaOH溶液起始温度和反应终止温度
B. 若2C(s) + O2(g) = 2CO(g) △H=—221.0kJ/mol,则碳的燃烧热为110.5 kJ/mol
C. 电解水可以获得H2和O2,该反应是放热反应
D. 已知I:反应H2(g)+Cl2(g)=2HCl(g) △H=-akJ/mol,II:![]() 且a、b、c均大于零,则断开1 mol H-Cl键所需的能量为2(a+b+c) kJ/mol
且a、b、c均大于零,则断开1 mol H-Cl键所需的能量为2(a+b+c) kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂离子电池广泛用作便携式电源,其正极材料是决定锂离子电池可逆容量与循环寿命的关键因素之一。锂二次电池一般以LiCoO2、LiFePO4等为正极材料,以石墨碳为负极材料,以溶有LPF6、LiBF4等的碳酸二乙酯(DEC)为电解液。充电时,Li+从正极层状氧化物的晶格间脱出进入有机电解液,有机电解液中的Li+则进入负极,得电子后以原子形式嵌入到石墨材料的晶格中,即:6C+xLi++xe-=LixC6,如图所示:

(1)如图所示,已知该电池电极总反应:LiCoO2+C![]() Li1-xCoO2+CLix,充电时,该电池的正极上的反应为_______________________。
Li1-xCoO2+CLix,充电时,该电池的正极上的反应为_______________________。
(2)放电时负极材料质量________(填“增加”、“减小”或“不变”)
(3)在实验室中,可用下列方案从废旧锂离子电池的正极材料中(主要含有LiCoO2、炭粉及少量Al、Fe等)回收钴和锂。
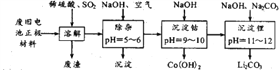
①溶解过程中,通入SO2时所发生反应的化学方程式为________________________;
②除杂过程中,所得沉淀的主要成分是___________________;(写化学式)
③常温下,已知Ksp[Co(OH)2]=1.09×10-15,若沉淀钴时pH=9.5,则溶液中Co2+是否沉淀完全?请列式计算说明。 _______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是重要的工业原料,在农业、医药、国防和化工等领域有重要应用。
I.(1)工业上用N2和H2在一定条件下合成氨,下列措施能使正反应速率增大,且使平衡混合物中NH3的体积分数一定增大的是______。
A.降低反应温度 B.压缩反应混合物 C.充入N2 D.液化分离NH3
(2)常温下向100m10.2mol/L的氨水中逐滴加入0.2mol/L的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O物质的量分数与加入盐酸的体积的关系如下图所示,根据图像回答下列问题。
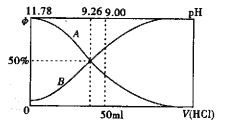
①表示NH3·H2O浓度变化的曲线是______(填“A”或“B")。
②NH3·H2O的电离常数为_______(已知1g1.8=0.26)
③当加入盐酸体积为50ml时,溶液中c(NH4+)-c(NH3·H2O)=____mol/L(用精确值表示)。
II.已知常温下,Ksp[Al(OH)3]=4.0×10-38,在AlCl3溶液中加入NaHCO3溶液产生沉淀和气体,反应的离子方程式为:________________;若将所得悬浊液的pH调整为3,则溶液中Al3+浓度为_____mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质的相互关系正确的是( )
A.同位素:H+、H2、2H、3H
B.同素异形体:C60、C70、C(石墨)
C.同分异构体:C3H8、C4H10
D.同系物:正丁烷、异丁烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲乙两同学对保存已久的Na2SO3试剂进行试验探究。取适量Na2SO3样品于洁净烧杯中,加入适量蒸馏水,充分搅拌全部溶解。
(1)测上述溶液的PH值,其PH值>7,原因是(用离子方程式表示)_____________________________________
(2)取少量上述溶液于试管中,加入硝酸钡溶液生成白色沉淀,再加入盐酸,白色沉淀不溶解,甲认为已变质,乙认为他的结论不科学,理由是________________________________
(3)假设试剂由Na2SO3和Na2SO4组成,设计试验方案,进行成分检验,他们决定继续探究,请写出实验步骤、预期现象和结论。
限选试剂及仪器:稀盐酸、稀硝酸、氯化钡溶液,品红溶液,酸性高锰酸钾溶液,NaOH溶液、澄清石灰水、pH计、烧杯、试管、带塞导气管、滴管
实验步骤 | 预期现象和结论 |
步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置。 | |
步骤2:取适量步骤1所得溶液于试管中 加入少量的____________________溶液。 | 若溶液褪色,说明其有_________若溶液不褪色,说明其中没有______ |
步骤3: 再取适量步骤1所得溶液于另一试管中,先加入足量的稀盐酸,再滴 加___________溶液。 | 如果有白色沉淀生成,则说明其中有_____________,已经变质。 如果没有白色沉淀生成,则说明其中 没有_____________ |
(4)经实验检验后,确实已变质,现准确测定其中Na2SO3的含量。实验如下:
①配制250ml 约0.2molL-1 Na2SO3溶液:准确称取w克试样,置于烧杯中,加适量蒸馏水溶解,将溶液转入____________,洗涤,定容,摇匀。
②滴定:准确量取25.00ml Na2SO3所配制溶液于锥形瓶中,将 0.05molL-1酸性高锰酸钾装入50ml__________(填酸式或碱式)滴定管,滴定至终点,记录数据。重复滴定2次。平均消耗KMnO4VmL。
③计算Na2SO3的质量分数=______________(只列出计算式,不要求算出结果)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲探究CO还原CuO,设计如图所示装置(夹持装置略去)。下列说法正确的是
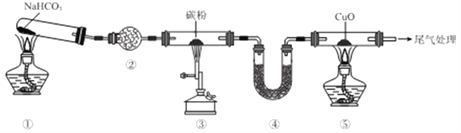
A. ②、④中均可盛装碱石灰
B. 加热的顺序为③、①、⑤
C. ①、③、⑤中均发生氧化还原反应
D. 可将尾气用导管通入到⑤的酒精灯处灼烧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com