
【题目】实验室欲探究CO还原CuO,设计如图所示装置(夹持装置略去)。下列说法正确的是
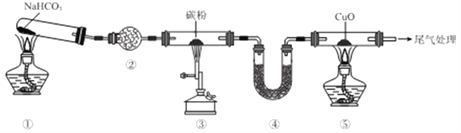
A. ②、④中均可盛装碱石灰
B. 加热的顺序为③、①、⑤
C. ①、③、⑤中均发生氧化还原反应
D. 可将尾气用导管通入到⑤的酒精灯处灼烧
【答案】D
【解析】由装置图可知,NaHCO3受热分解生成Na2CO3、H2O和CO2,用装置②除去CO2中混有的H2O(g),CO2与碳粉加热反应生成CO,用装置④除去剩余的CO2,CO与CuO固体加热反应生成CO2和Cu,最后进行尾气处理除去剩余的CO。A. ②中若盛装碱石灰,会把CO2和H2O(g)一并除去,因此②中应盛装P2O5等干燥剂,装置④的作用是除去剩余的CO2,所以装置④中可盛装碱石灰,故A错误;B. 因碳粉会和空气中的氧气、水蒸气等在加热时发生反应,所以应先加热装置①,待整个装置中充满CO2时,再加热③和⑤,故B错误;C. 装置①中发生的是NaHCO3受热分解生成Na2CO3、H2O和CO2的反应,该反应中没有元素化合价发生变化,不是氧化还原反应,③中发生的反应为C+CO2![]() 2CO、⑤中发生的反应为CO+CuO
2CO、⑤中发生的反应为CO+CuO![]() Cu+CO2,这两个反应中均有元素化合价发生变化,属于氧化还原反应,故C错误;D. 处理尾气CO通常采用点燃的方法,使CO燃烧生成无污染的CO2,故D正确;答案选D。
Cu+CO2,这两个反应中均有元素化合价发生变化,属于氧化还原反应,故C错误;D. 处理尾气CO通常采用点燃的方法,使CO燃烧生成无污染的CO2,故D正确;答案选D。


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】科研人员设计一种电化学反应器以Na2SO4溶液为电解质,负载纳米MnO2的导电微孔钛膜和不锈钢为电极材料。这种电催化膜反应器可用于正丙醇合成丙酸,装置示意图:

以下叙述错误的是
A. 微孔钛膜作阴极
B. 使用Na2SO4溶液是为了在电解开始时增强溶液导电性
C. 丙醇转化为丙酸的电极反应式为:CH3CH3CH2OH+H2O-4e-=CH3CH2COOH+4H+
D. 反应器工作时料槽中正丙醇分子向电催化膜移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.1 molH2的质量是1 g
B.1 mol HCl的质量是36.5 gmol﹣1
C.Cl2的摩尔质量等于它的相对分子质量
D.硫酸根离子的摩尔质量是96 gmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是一种常见的元素,它以多种形式广泛存在于自然界之中。
(1)星际空间存在多种有机分子和无机分子,多数都含有碳元素,C2是一种星际分子,C2和C60互为_______________。
(2)CO2是碳元素重要的氧化物,回答下列有关问题:
①利用CO2与Na2O2反应,可向呼吸面具中提供氧气,其反应方程式为_________________。
②工业上可由CO2和NH3在一定条件下合成尿素,反应方程式为2NH3+CO2![]() CO(NH2)2+H2O当
CO(NH2)2+H2O当![]() 时,CO2的转化率随时间的变化关系如图所示.
时,CO2的转化率随时间的变化关系如图所示.
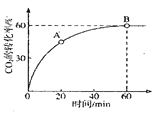
A点的逆反应速率![]() __________B点的正反应速率
__________B点的正反应速率![]() (填“大于“小于”或“等于”),NH3的平衡转化率为____________。
(填“大于“小于”或“等于”),NH3的平衡转化率为____________。
③随着对环境问题认识的深入,CO2的转化捕获问题已成为科研热点之一,以附着纳米银的惰性电极作阴极,可电解CO2转化为CO,装置示意图如下:
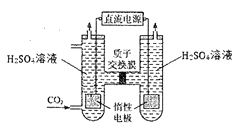
写出通CO2侧电极反应式_________________。
④CO2可用于生产碳酸饮料。苯甲酸钠(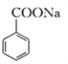 可写为C6H5COONa)也是某些饮料的添加剂,具有抑菌防腐的作用。研究表明苯甲酸(C6H5COOH)的抑菌能力显著高于苯甲酸钠。在生产的某饮料的过程中,除了添加苯甲酸钠外,还需加压充入CO2气体。若忽略碳酸的二级电离,试写出碳酸与苯甲酸钠反应的离子方程式__________________,经计算该反应的化学平衡常数为______________,加压充入CO2后,该饮料的抑菌能力明显增强,结合上述离子方程式分析其原因_______________(已知:H2CO3的Ka1=4.17×10-7;C6H5COOH的Ka=6.25×10-5。)。
可写为C6H5COONa)也是某些饮料的添加剂,具有抑菌防腐的作用。研究表明苯甲酸(C6H5COOH)的抑菌能力显著高于苯甲酸钠。在生产的某饮料的过程中,除了添加苯甲酸钠外,还需加压充入CO2气体。若忽略碳酸的二级电离,试写出碳酸与苯甲酸钠反应的离子方程式__________________,经计算该反应的化学平衡常数为______________,加压充入CO2后,该饮料的抑菌能力明显增强,结合上述离子方程式分析其原因_______________(已知:H2CO3的Ka1=4.17×10-7;C6H5COOH的Ka=6.25×10-5。)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,既属于氧化还原反应同时又是吸热反应的是
A.灼热的炭与CO2反应B.甲烷与O2的燃烧反应
C.铝与稀盐酸D.Ba(OH)2·8H2O与NH4Cl反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用NaOH溶液滴定H2C2O4 溶液,溶液中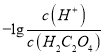 和-lgc(HC2O4-)或
和-lgc(HC2O4-)或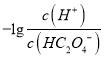 和-lgc(C2O42-)关系如图所示,下列说法正确的是
和-lgc(C2O42-)关系如图所示,下列说法正确的是
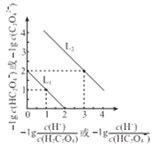
A. 曲线L1表示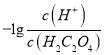 和-lgc(HC2O4-)的关系
和-lgc(HC2O4-)的关系
B. Ka2(H2C2O4)的数量级为10-2
C. NaHC2O4溶液中c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
D. 向0.1mol/LH2C2O4溶液中加入少量水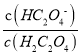 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬是人体必需元素,如含量不足会影响糖类和脂类的代谢,过高则会引起急性中毒。工业上往往采取下列循环工艺防止铬的污染:

完成下列填空:
(1)含Cr2O72-离子的废水在酸性条件下用Fe3O4处理,反应的离子方程式如下,配平该离子反应方程式:
_____Cr2O72-+Fe3O4+H+→Cr3++Fe3++H2O
(2)工业上处理含Cr2O72-的废水时,一般将剧毒的Cr2O72-转化为Cr3+,以碳为阴极,铁作阳极,电解处理含NaCl、Cr2O72-的酸性废水。写出电极反应:阳极_____________________ 阴极_______________________;用铁做阳极的目的是:_____________________
(3)反应⑤是可逆反应,在Na2CrO4溶液中加入稀硫酸,溶液由黄色逐渐变成橙色,写出该反应的离子方程式:______________________
(4)已知Ag2CrO4和AgCl的Ksp分别为9.0×10-12、1.56×10-10,向含有相同浓度的Na2CrO4和NaCl的混合溶液中逐滴加入硝酸银溶液,首先生成的沉淀是__________
(5)向上述反应后的溶液中加入碱溶液,让废水的pH升至8~10,控制适当的温度,使产物中的金属阳离子全部转变为沉淀。回收所得的Cr(OH)3,经处理后又可转变成K2Cr2O7。纯净的K2Cr2O7常用于准确测定Na2S2O3溶液的物质的量浓度,方法如下:① Cr2O72- +6I- + 14H+ →3I2 + 2Cr3+ + 7H2O ② 2S2O32- + I2→S4O62- + 2I- ,准确称取纯净的K2Cr2O7 0.294g ,配成溶液,用Na2S2O3溶液滴定,消耗Na2S2O3溶液25.00mL。则Na2S2O3溶液的物质的量浓度为_____________________(保留四位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金刚石和石墨均为碳的同素异形体,氧气不足时它们燃烧生成一氧化碳,充分燃烧时生成二氧化碳,反应中放出的热量如图所示。

(1)写出石墨转化为金刚石的热化学方程式____________________________________。
(2)写出石墨和二氧化碳反应生成一氧化碳的热化学方程式_____________________。
(3)科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:
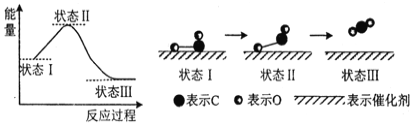
①判断CO和O生成CO2是放热反应的依据是__________________。
②写出CO2的电子式___________________,CO2含有的化学键类型是(若含共价键,请标明极性或非极性)______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com