


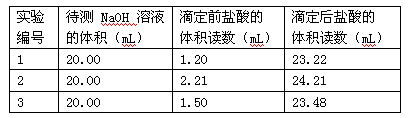
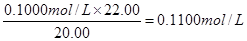 。
。

科目:高中化学 来源:不详 题型:单选题
| A.常温下,将pH=3的醋酸溶液加水稀释到原体积的10倍后,溶液的pH=4 |
| B.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
| C.pH=13的NaOH溶液与pH=1的醋酸溶液等体积混合后所得溶液的pH>7 |
| D.向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中:c(NH4+) = c(Cl-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.pH=3的盐酸中,其c(H+)是pH=1的盐酸中的3倍 |
| B.1mol/L0.5L的 AlCl3溶液中,阳离子的物质的量大于0.5mol |
| C.同温度同物质的量浓度时,HF比HCN易电离,则NaF溶液的 pH 比 NaCN 溶液大 |
| D.在由水电离出的c(H+) = 1×10-12mol/L的溶液中,K+、ClO-、SO42-一定能大量共存 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2c1=c2 | B.2c2=c1 | C.c2>2c1 | D.c1<c2<2c1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.溶液中(H+)的物质的量增大 | B.溶液中c(H+)增大 |
| C.溶液中c(H+)/ c(CH3OOH)增大 | D.溶液的pH增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.4 | B.6 | C.8 | D.10 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.a>b | B.a<b | C.a=b | D.无法判断 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
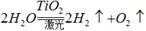 。有下列几种说法:① 水分解反应是放热反应;②若用生成的氢气与空气中多余的二氧化碳反应生成甲醇储存起来,可改善生存条件;③ 使用氢气作燃料有助于控制温室效应;④氢气是一级能源。其中叙述正确的是
。有下列几种说法:① 水分解反应是放热反应;②若用生成的氢气与空气中多余的二氧化碳反应生成甲醇储存起来,可改善生存条件;③ 使用氢气作燃料有助于控制温室效应;④氢气是一级能源。其中叙述正确的是 | A.①② | B.③④ | C.②③ | D.①②③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| A.用标准溶液润洗滴定管2~3次 |
| B.取标准KOH溶液注入碱式滴定管至刻度0以上2~3cm |
| C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液 |
| D.调节液面至0或0以下刻度,记下读数 |
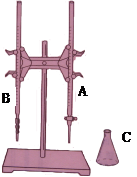
| 实验次数 | c(KOH)/mol·L-1 | B中起点刻度 | B中终点刻度 | V(HCl)/ml |
| 1 | 0.1000 | 0 | 24.95 | 25.00 |
| 2 | 0.1000 | 0 | 24.96 | 25.00 |
| 3 | 0.1000 | 0 | 24.50 | 25.00 |
| 4 | 0.1000 | 0 | 24.94 | 25.00 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com