
| ||
| ||
| ||
| A、①③为置换反应 |
| B、①②③均为氧化还原反应 |
| C、①②③均为非离子反应 |
| D、三个反应中硅元素均被还原 |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸式盐的水溶液一定显碱性 |
| B、醋酸铵溶液呈中性是因为溶液中H+的物质的量和OH-的物质的量相等 |
| C、NaHSO3溶液的PH大于Na2SO4溶液的PH |
| D、只要酸与碱的物质的量浓度和体积分别相等,它们反应后的溶液就呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、①②⑤ | C、④ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、KOH(aq)+
| ||||
| B、NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=+57.3 kJ?mol-1 | ||||
| C、H2SO4和Ca(OH)2反应的中和热为△H=2×(-57.3)kJ?mol-1 | ||||
| D、稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、重金属盐中毒的病人服用鸡蛋清解毒 |
| B、高温消毒医疗器械 |
| C、用甲醛的水溶液保存标本 |
| D、把生理盐水静脉注射到人体内 |
查看答案和解析>>
科目:高中化学 来源: 题型:
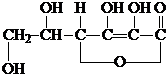 2014年8月28日,第二届夏季青年奥林匹克运动会(以下简称“青奥会”)在南京奥体中心顺利闭幕.请完成下列与“青奥会”有关的填空.
2014年8月28日,第二届夏季青年奥林匹克运动会(以下简称“青奥会”)在南京奥体中心顺利闭幕.请完成下列与“青奥会”有关的填空.查看答案和解析>>
科目:高中化学 来源: 题型:
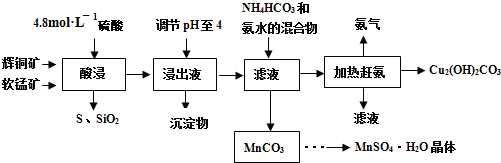
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com