
【题目】氯化亚铜(CuCl,白色、易被氧化,Ksp=1.2×10-6)广泛用作催化剂、脱臭剂、脱色剂等。工业上用初级铜矿粉(主要含Cu2S、CuS、Fe2O3、FeO等)制备活性CuCl的流程如下:
(1)反应Ⅰ中Cu2S参与反应的化学方程式为:Cu2S+MnO2 + H2SO4→CuSO4 +S+MnSO4 + H2O(未配平);滤渣Ⅰ成分是:__________。

(2)除Mn2+时得MnCO3沉淀,该反应的离子方程式为_________________________。
(3)已知:Cu(OH)2可溶于氨水形成深蓝色溶液。
Cu(OH)2+4NH3![]() [Cu(NH3)4]2++2OH-。蒸氨条件及蒸氨效果见下表:
[Cu(NH3)4]2++2OH-。蒸氨条件及蒸氨效果见下表:
序号 | 温度/℃ | 时间/min | 压强/KPa | 残液颜色 |
a | 110 | 60 | 101.3 | 浅蓝色 |
b | 100 | 40 | 74.6 | 几乎很浅 |
c | 90 | 30 | 60.0 | 无色透明 |
由表中信息可知蒸氨的条件应选_______(填序号),请用平衡移动原理解释选择该条件的原因是________________________________。
(4)反应Ⅱ的离子方程式___________________________。
(5)实验证明通过如图装置也可获得CuCl,现象为

阴极:产生无色气体;
阳极:有白色胶状沉淀生成且逐渐增多;
U形管底部:靠近阴极区白色胶状沉淀逐渐转化为淡黄色沉淀。
①生成CuCl的电极反应式为________________________________。
②有同学提出:淡黄色沉淀可能是CuOH,以下是从资料中查阅到CuOH的有关信息,哪些不能支持该同学的说法________。(填序号)
a.容易脱水变成红色的Cu2O
b.CuOH是黄色或淡黄色固体,不溶于水
c.CuOH的Ksp=2×10-15
d.易被氧化成Cu(OH)2
【答案】Fe(OH)3和S Mn2+ +HCO3-+NH3·H2O===MnCO3↓+NH4++H2O c 减小压强,平衡逆向移动,利于蒸氨 SO2 +2Cu2++2Cl+2H2O===2CuCl↓+SO42-+4H+ Cu-e+Cl===CuCl↓ ad
【解析】
以初级铜矿粉(主要含Cu2S、CuS、Fe2O3、FeO等)制备氯化亚铜的路线为:在反应I中向铜矿粉中加入硫酸溶液、二氧化锰,发生氧化还原反应生成硫单质,二氧化锰被还原为二价锰离子留在溶液中,溶液中含有铜离子、铁离子;向溶液中加入氨水,沉淀铁离子为氢氧化亚铁,过滤,滤渣Ⅰ是Fe(OH)3和单质硫的混合物,然后滤液中加入碳酸氢铵除锰离子,二价锰离子转化为碳酸锰沉淀,然后蒸氨得到氢氧化铜沉淀,再用盐酸溶解CuO得到CuCl2,通入二氧化硫气体得到氯化亚铜沉淀,以此解答该题。
(1)由上述分析可知,滤渣I为Fe(OH)3和S;
(2)除Mn2+时加入氨水和NH4HCO3得MnCO3沉淀,反应的离子方程式为Mn2+ +HCO+NH3·H2O===MnCO3↓+NH4++H2O;
(3)根据流程,蒸氨时[Cu(NH3)4]2+先变成Cu(OH)2,根据表中信息,c得到的残液颜色为无色透明,说明[Cu(NH3)4]2+转化率很大,蒸氨的条件应选c。选择该条件的原因是:减小压强,平衡Cu(OH)2+4NH3![]() [Cu(NH3)4]2++2OH-逆向移动,利于蒸氨;
[Cu(NH3)4]2++2OH-逆向移动,利于蒸氨;
(4)反应II为向CuCl2溶液中通入SO2制得CuCl,CuCl2被还原成CuCl,SO2被氧化成SO42-,反应的化学方程式为2CuCl2+SO2+2H2O=== 2CuCl↓+H2SO4+2HCl,反应II的离子方程式为SO2 +2Cu2++2Cl+2H2O===2CuCl↓+SO42-+4H+;
(5)①在电解池中阳极发生失电子的氧化反应,根据装置图,阳极Cu失电子生成CuCl,生成CuCl的电极反应式为Cu-e+Cl===CuCl↓;
②靠近阴极区白色胶状沉淀逐渐转化为淡黄色沉淀,淡黄色沉淀可能是CuOH(题中有信息说明CuOH是黄色或淡黄色固体,不溶于水)电解时阴极电极反应式为2H2O+2e===H2↑+2OH,阴极区溶液呈碱性,Ksp(CuCl)=1.2×106>Ksp(CuOH)=2×1015,CuOH的溶解度小于CuCl,在阴极区CuCl转化为更难溶的CuOH;故b和c可以支持该同学的说法。无论是氢氧化亚铜分解为红色的氧化亚铜,还是氧化为蓝色的氢氧化铜,由于在实验过程中没有观察到相应的现象,故不能支持该同学的说法,答案选ad。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】将2.8 g CO和0.2 g H2在足量的氧气中充分燃烧,使生成的CO2和水蒸气通过过量的过氧化钠,完全反应后固体的质量变化量是( )
A. 增加了3.0 gB. 减少了3.0 gC. 增加了2.6 gD. 减少了2.6 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里用如图所示仪器和药品来制取纯净的无水氯化铜(Cu+Cl2![]() CuCl2)。图中A、B、C、D、E、F表示玻璃管接口,接口的弯曲和伸长等部分未画出。根据要求填写下列各小题空白。
CuCl2)。图中A、B、C、D、E、F表示玻璃管接口,接口的弯曲和伸长等部分未画出。根据要求填写下列各小题空白。

(1)如果所制气体从左向右流向时,上述各仪器装置的正确连接顺序是(填各装置的序号)(____)接(____)接(____)接(____)接(____)接(____),其中②与④装置相连时,玻璃管接口(用装置中字母表示)应是___接___。
(2)装置②的作用是___;装置④的作用是___。
(3)实验开始时,应首先检验装置的____,实验结束时,应先熄灭___处的酒精灯。
(4)在装置⑤的烧瓶中,发生反应的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2分)N2H4是一种高效清洁的火箭燃料.0.25mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量.则下列热化学方程中正确的是( )
A.![]() N2H4(g)+
N2H4(g)+![]() O2(g)=
O2(g)=![]() N2(g)+H2O(l)△H=+257kJmol﹣1
N2(g)+H2O(l)△H=+257kJmol﹣1
B.N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=﹣133.5kJmol﹣1
C.N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=+534kJmol﹣1
D.N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=﹣534kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂除去杂质,从而得到纯净的NaNO3晶体,相应的实验流程如图所示。

请回答下列问题:
(1)写出实验流程中下列物质的化学式:试剂X___,沉淀A____。
(2)上述实验流程中①②③步均要进行的实验操作是___(填操作名称)。
(3)上述实验流程中加入过量Na2CO3溶液的目的是______________________________。
(4)按此实验方案得到的溶液3中肯定含有______(填化学式)杂质。为了解决这个问题,可以向溶液3中加入适量的___(填化学式),之后若要获得NaNO3晶体,需进行的实验操作是____(填操作名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式与事实相符且书写正确的是( )
A. 炼铁高炉中生成铁:3C+2Fe2O3![]() 4Fe+3CO2↑
4Fe+3CO2↑
B. 铝放入稀硫酸中:Al+H2SO4=AlSO4+H2↑
C. 向氢氧化钠溶液中加入硫酸铜溶液:2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
D. 向小苏打中滴加稀硫酸: Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以A和B为原料合成扁桃酸衍生物F的路线如下:

(1)A的分子式为C2H2O3,可发生银镜反应,且具有酸性,A所含官能团的名称为_________。写出A+B![]() C的反应类型:_________。
C的反应类型:_________。
(2) 中①、②、③三个-OH与钠反应活性由强到弱的顺序是_____。
中①、②、③三个-OH与钠反应活性由强到弱的顺序是_____。
(3)E是由2分子C生成的含有3个六元环的化合物,E分子核磁共振氢谱峰面积之比_______。
(4)D![]() F的反应方程式是______________,1molF在一定条件下与足量NaOH溶液反应,最多消耗NaOH的物质的量为____________mol,符合下列条件的F的所有同分异构体有四种(不考虑立体异构),写出其中两种的结构简式:___________。
F的反应方程式是______________,1molF在一定条件下与足量NaOH溶液反应,最多消耗NaOH的物质的量为____________mol,符合下列条件的F的所有同分异构体有四种(不考虑立体异构),写出其中两种的结构简式:___________。
①属于一元酸类化合物 ②苯环上只有2个取代基且处于对位,其中一个是羟基
(5)已知: ,下列流程是A的一种合成方法___________,写出方框中各物质的结构简式:
,下列流程是A的一种合成方法___________,写出方框中各物质的结构简式:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于0.10 mol·L-1 NaHCO3溶液的说法正确的是( )
A. 溶质的电离方程式为NaHCO3===Na++H++CO![]()
B. 25 ℃时,加水稀释后,n(H+)与n(OH-)的乘积变大
C. 离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO![]() )+c(CO
)+c(CO![]() )
)
D. 温度升高,c(HCO![]() )增大
)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关一定物质的量浓度溶液的配制说法中正确的是( )
(1)为准确配制一定物质的量浓度的溶液,定容过程中向容量瓶内加蒸馏水至接近刻度线时,改用胶头滴管滴加蒸馏水至刻度线
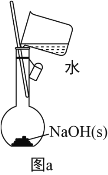
(2)利用图a配制0.10molL-1NaOH 溶液
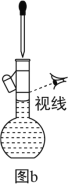
(3)利用图b配制一定浓度的NaCl溶液
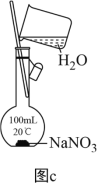
(4)利用图c配制一定物质的量浓度的NaNO3溶液
(5)用容量瓶配制溶液时,若加水超过刻度线,立即用滴管吸出多余液体
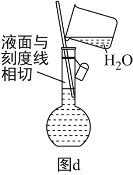
(6)配制溶液的定容操作可以用图d表示
A. (2)(5)B. (1)(4)(6)
C. (1)D. (1)(3)(5)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com