
【题目】亚磷酸(H3PO3)是二元弱酸,可用于农药中间体以及有机磷水处理剂的原料。常温下向1L0.5mol·L-1H3PO3溶液中滴加等浓度的NaOH溶液,混合溶液中含磷粒子的物质的量分数(δ)与溶液pH的关系如图所示,下列说法正确的是( )
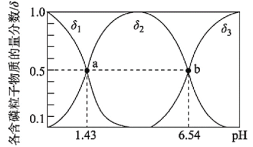
A.a、b两点,水分别电离出的c(OH-)水之比为10-6.54:10-1.43
B.b点对应溶液中存在:c(Na+)>3c(HPO32-)
C.当V(NaOH)=1L时,c(Na+)>c(H2PO3-)>c(H3PO3)>c(HPO32-)
D.反应H3PO3+HPO32-![]() 2H2PO3-的平衡常数为105.11
2H2PO3-的平衡常数为105.11
【答案】AD
【解析】
A.a点、b点水电离出的c水(OH-)之比=![]() :
:![]() ;
;
B.b点c(H2PO3)=c(HPO32),溶液pH=6.54<7,溶液呈酸性,则c(OH)<c(H+),根据电荷守恒得c(Na+)<2c(HPO32)+c(H2PO3);
C.V(NaOH)=1L时,二者恰好完全反应生成NaH2PO3,H2PO3水解平衡常数=![]() =107.46<Ka2,说明其电离程度大于水解程度,溶液呈酸性,但是其电离程度较小;
=107.46<Ka2,说明其电离程度大于水解程度,溶液呈酸性,但是其电离程度较小;
D.c(H2PO3)=c(H3PO3)时Ka1=c(H+)=101.43,c(H2PO3)=c(HPO32)时,Ka2=c(H+)=106.54,H3PO3+HPO322H2PO3的平衡常数为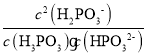 =
=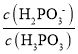 ×
×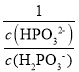 =
=![]() ×
×![]() =
=![]() 。
。
A.a点、b点水电离出的c水(OH-)之比=![]() :
:![]() =10-6.54:10-1.43,故A正确;
=10-6.54:10-1.43,故A正确;
B.b点c(H2PO3)=c(HPO32),溶液pH=6.54<7,溶液呈酸性,则c(OH)<c(H+),根据电荷守恒得c(Na+)<2c(HPO32)+c(H2PO3),则c(Na+)<3c(HPO32),故B错误;
C.V(NaOH)=1L时,二者恰好完全反应生成NaH2PO3,H2PO3水解平衡常数=![]() =107.46<Ka2,说明其电离程度大于水解程度,溶液呈酸性,c(H+)>c(OH),根据电荷守恒得c(Na+)>c(H2PO3),但是其水解程度较小,所以存在c(Na+)>c(H2PO3)>c(HPO32-)>c(H3PO3),故C错误;
=107.46<Ka2,说明其电离程度大于水解程度,溶液呈酸性,c(H+)>c(OH),根据电荷守恒得c(Na+)>c(H2PO3),但是其水解程度较小,所以存在c(Na+)>c(H2PO3)>c(HPO32-)>c(H3PO3),故C错误;
D.c(H2PO3)=c(H3PO3)时Ka1=c(H+)=101.43,c(H2PO3)=c(HPO32)时,Ka2=c(H+)=106.54,H3PO3+HPO322H2PO3的平衡常数为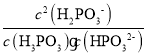 =
=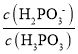 ×
×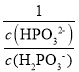 =
=![]() ×
×![]() =
=![]() =
=![]() =105.11,故D正确;
=105.11,故D正确;
故答案选AD。


 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】工业上常用铁碳混合物处理含Cu2+废水获得金属铜。当保持铁屑和活性炭总质量不变时,测得废水中Cu2+浓度在不同铁碳质量比(x)条件下随时间变化的曲线如下图所示。
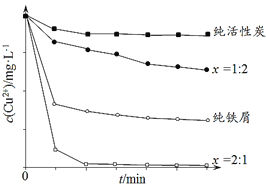
下列推论不合理的是
A. 活性炭对Cu2+具有一定的吸附作用
B. 铁屑和活性炭会在溶液中形成微电池,铁为负极
C. 增大铁碳混合物中铁碳比(x),一定会提高废水中Cu2+的去除速率
D. 利用铁碳混合物回收含Cu2+废水中铜的反应原理:Fe+Cu2+=Fe2++Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜锌银精矿化学成分如下:
元素 | Cu | Zn | Ag | S | Fe | Pb |
元素质量分数/% | 17.60 | 18.30 | 0.146 | 33.15 | 18.17 | 7.86 |
利用铜锌银精矿制备硫酸铜晶体的流程如下:

回答下列问题:
(l)“气体A”为____(填化学式),“浸渣”中主要为硫酸铅和____(填化学式)。
(2)“沉铜”得到Cu2Cl2固体,目的是____________。
(3)“氧化”工序中,恰好反应时氧化剂和还原剂物质的量之比为____。
(4)“母液2”中阴离子含量最多的是____,该溶液最好返回 __工序循环使用。
(5)依据铜锌银精矿化学成分进行分析,精矿中含有FeS2,理由是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.14.0gFe发生吸氧腐蚀生成Fe2O3·xH2O,电极反应转移的电子数为0.5NA
B.标准状况下,11.2LH2S溶于水,溶液中含硫粒子的数目大于0.5NA
C.常温下,0.5LpH=14的Ba(OH)2溶液中Ba2+的数目为0.5NA
D.向100mL0.5mol·L-1Fe(NO3)3溶液中通入足量SO2气体,转移电子数为0.05NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体粉末X中可能含有Fe、Fe2O3、K2SiO3、K2SO3、K[Al(OH)4]、MgCl2、K2CO3中的若干种。为确定该固体粉末的成分,现取X进行连续实验,实验过程及现象如下:
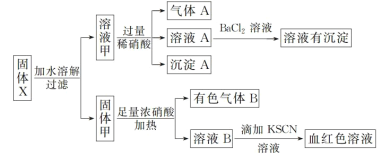
根据上述实验,以下说法正确的是( )
A.气体A一定只是NO
B.由于在溶液A中加入BaCl2溶液有沉淀产生,因此可以判断溶液甲中含有K2SO3
C.若向固体甲中加入足量浓盐酸,再加KSCN溶液,没有血红色,则证明原混合物中一定没有Fe2O3
D.溶液甲中一定含有K2SiO3,可能含有K[Al(OH)4]、MgCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组微粒在指定溶液中可能大量共存的是( )
A.![]() =1×1014的溶液:NH4+、CrO42-、HS-
=1×1014的溶液:NH4+、CrO42-、HS-
B.含大量NO3-的溶液:Fe2+、SO42-、H+
C.水电离产生的c(OH-)=10-13 mol/L的溶液:Mg2+、Na+、Cl-
D.甲基橙呈红色的溶液:NH4+、Ba2+、HCO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某恒容密闭容器中充入一定量SO2和O2进行反应: 2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0,图甲表示反应速率(v)与温度(T) 的关系、图乙表示 T1 时,平衡体系中SO2的体积分数与压强(p)的关系。下列说法正确的是( )
2SO3(g) ΔH<0,图甲表示反应速率(v)与温度(T) 的关系、图乙表示 T1 时,平衡体系中SO2的体积分数与压强(p)的关系。下列说法正确的是( )
图甲 ,图乙
,图乙
A.图甲中,曲线1表示正反应速率与温度的关系
B.图乙中,a、b两点的反应速率:v(a)>v(b)
C.图甲中,d点时,混合气体的平均摩尔质量不再改变
D.图乙中,c点的正、逆反应速率:v(逆) < v(正)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
T(℃) | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K =_______。
(2)该反应为______反应(选填“吸热”、“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是_____。
a.容器中压强不变 b.υ正(H2)=υ逆(H2O)
c. c(CO2)=c(CO) d.混合气体中 c(CO)不变
(4) 830K时,各物质浓度符合下式:2c(CO2)·c(H2)=c(CO)·c(H2O),此时该反应 _______(填“正反应方向进行”、“逆反应方向进行”或“处于平衡状态”)。
Ⅱ.将1 mol I2(g) 和2 mol H2置于2 L密闭容器中,在一定温度下发生反应: I2(g) + H2(g) ![]() 2HI(g);△H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:
2HI(g);△H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:
(1)若5分钟该达平衡,则用H2表示的反应速率为________。
(2)若改变反应条件,在甲条件下w(HI)的变化如曲线(Ⅰ) 所示,则甲条件可能是____。(填入下列条件的序号)
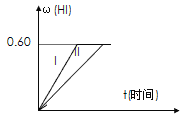
①恒温条件下,缩小反应容器体积;②恒温条件下,扩大反应容器体积;③恒容条件下,降低温度;④恒容条件下,升高温度;⑤恒温恒容条件下,加入适当催化剂。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外研究小组设计数字化实验探究温度对盐类水解反应的影响。通过加热50mL 0.1000mol/L的Na2CO3标准溶液进行实验,测得溶液的pH随温度变化的关系如图所示,下列说法不正确的是
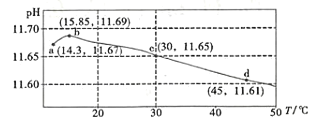
A.由ab段可得结论:CO32-(aq)+H2O(l)HCO3-(aq)+OH-(aq) H>0
B.e点溶液中:(OH- )=c(H+)+c( HCO3-)+2c( H2CO3)=1×10-3.35mol/L
C.bd段pH减小是水的Kw随着温度的升高而增大所致
D.从a→d随着温度升高,![]() 始终增大
始终增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com