
【题目】常温下,下列各组微粒在指定溶液中可能大量共存的是( )
A.![]() =1×1014的溶液:NH4+、CrO42-、HS-
=1×1014的溶液:NH4+、CrO42-、HS-
B.含大量NO3-的溶液:Fe2+、SO42-、H+
C.水电离产生的c(OH-)=10-13 mol/L的溶液:Mg2+、Na+、Cl-
D.甲基橙呈红色的溶液:NH4+、Ba2+、HCO3-、Cl-
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】不同元素的气态原子失去最外层一个电子所需要的能量(设其为E)如下图所示。试根据元素在周期表中的位置,分析图中曲线的变化特点,并回答下列问题。1至19号元素气态原子失去最外层一个电子所需能量

(1)同主族内不同元素的E值变化的特点是_______。各主族中E值的这种变化特点体现了元素性质_______变化规律。
(2)同周期内,随原子序数增大,E值增大。但个别元素的E值出现反常现象。试预测下列关系中正确的是_______(填写编号)。
①E(砷)>E(硒) ②E(砷)<E(硒)
③E (溴)>E(硒) ④E(溴)<E(硒)
(3)估计l mol气态Ca原子失去最外层一个电子所需能量E值的范围_______<E<_______。
(4)10号元素E值较大的原因______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图所示装置进行铁和水蒸气反应的实验。
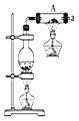
(1)铁粉与水蒸气反应的化学方程式是:________
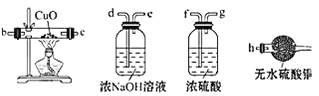
(2)为检验生成的气体产物,需从图中选择必要的装置,其正确的连接顺序为![]() 用接口字母表示
用接口字母表示![]() :
:![]() __
__![]() __
__![]() __
__![]() __
__![]() __,描述能验证气体产物的实验现象______。
__,描述能验证气体产物的实验现象______。
(3)停止反应,待装置冷却后,取出反应过的铁粉混合物,加入过量的稀硫酸充分反应,过滤.经检验上述滤液中不含![]() ,这不能说明铁粉与水蒸气反应所得产物中不含
,这不能说明铁粉与水蒸气反应所得产物中不含![]() 价的铁.原因是
价的铁.原因是![]() 用离子方程式说明
用离子方程式说明![]() :________
:________
(4)为了得到白色的![]() 沉淀,并尽可能使沉淀长时间保持白色,有同学设计如图所示的装置。通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是 ________
沉淀,并尽可能使沉淀长时间保持白色,有同学设计如图所示的装置。通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是 ________ ![]() 填序号
填序号![]()
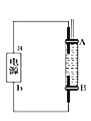
A.电源中的b为正极,a为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是![]()
(5)高铁酸钠![]() 是一种新型净水剂.高铁酸钠可以与水反应生成红褐色胶状物并放出无色气体,写出高铁酸钠与水反应的离子方程式___________
是一种新型净水剂.高铁酸钠可以与水反应生成红褐色胶状物并放出无色气体,写出高铁酸钠与水反应的离子方程式___________
(6)用![]() 溶液滴定可以进行铁元素含量的测定
溶液滴定可以进行铁元素含量的测定![]() ,步骤如下:
,步骤如下:
a.称取![]() 绿矾
绿矾![]() 产品,溶解,在250mL容量瓶中定容;
产品,溶解,在250mL容量瓶中定容;
b.量取![]() 待测溶液于锥形瓶中;
待测溶液于锥形瓶中;
c.用硫酸酸化的![]() 溶液滴定至终点。
溶液滴定至终点。
重复三次滴定实验所消耗![]() 溶液的体积如下表:
溶液的体积如下表:
滴定序号 | 消耗 |
1 |
|
2 |
|
3 |
|
计算上述样品中![]() 的质量分数为_____________。
的质量分数为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的化学用语不正确的是
A. 闪锌矿(ZnS)经CuSO4溶液作用后,转化为铜蓝(CuS):ZnS + Cu2+ === CuS + Zn2+
B. 0.1 mol/L 的醋酸溶液pH约为3:CH3COOH ![]() CH3COO- + H+
CH3COO- + H+
C. 电解NaCl溶液,阴极区溶液pH增大:2H2O + 2e- === H2↑+ 2OH-
D. 钢铁发生吸氧腐蚀,负极反应为:Fe-3e- === Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2与碱金属等单质在较高温度下可以化合形成离子型金属氢化物,如NaH、LiH等,它们具有极强的还原性,也是良好的野外生氢剂(NaH+H2O=NaOH+H2↑),下列说法不正确的是
A.金属氢化物具有强还原性的原因是其中的氢元素为-l价
B.NaH的电子式可表示为Na+[:H]-
C.NaAlH4与水反应:NaAlH4+H2O=NaOH+Al(OH)3+H2↑
D.工业上用有效氢含量衡量含氢还原剂的供氢能力,有效氢指单位质量(克)的含氢还原剂的还原能力相当于多少克氢气的还原能力。则LiAlH4的有效氢含量约为0.21
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用化学用语解释相关现象正确的是( )
A.向KI-淀粉溶液中滴加稀硫酸,溶液变蓝色:4I-+O2+2H2O=2I2+4OH-
B.常温下,0.1 mol/L的HF 溶液的pH>1:HF+H2O![]() H3O++F-
H3O++F-
C.KHSO4在熔融状态下可导电:KHSO4 = K++H++SO42-
D.BaSO4的水溶液导电性极弱:BaSO4![]() Ba2++SO42-
Ba2++SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研团队研究将磷钨酸(H3PW12O40,以下简称HPW)代替浓硫酸作为酯化反应的催化剂,但HPW自身存在比表面积小、易溶于有机溶剂而难以重复使用等缺点,将其负载在多孔载体(如硅藻土、C等)上则能有效克服以上不足,提高其催化活性。用HPW负载在硅藻土上催化制取乙酸正丁酯的酯化率与HPW负载量的关系(温度:120℃,时间:2h)如图所示,下列说法不正确的是

A.与HPW相比,HPW/硅藻土比表面积显著增加,有助于提高其催化性能
B.当HPW负载量为40%时达到饱和,酯化率最高
C.用HPW/硅藻土代替传统催化剂,可减少设备腐蚀等不足
D.不同催化剂对酯化率的影响程度主要取决于化学反应正向进行的程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原滴定原理同中和滴定原理相似,为了测定某未知浓度的NaHSO3溶液的浓度,现用0.2000mol/L的酸性KMnO4溶液进行滴定,回答下列问题:
(1) 配平离子方程式:______MnO4-+HSO3-+H+=Mn2++SO42-+H2O。
(2)用KMnO4进行滴定时,KMnO4溶液应装在_______________中,判断滴定终点的现象是_______。
(3)下列操作会导致测定结果偏高的是_________。
A. 盛装未知浓液的锥形瓶用蒸馏水洗过,未用待测液润洗
B. 未用标准浓度的酸性KMnO4溶液润洗滴定管
C. 观察读数时,滴定前仰视,滴定后俯视
D. 滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
(4) 根据下表测定的实验数据,计算KMnO4溶液体积的平均值为___mL;NaHSO3溶液的物质的量浓度为___mol/L(数据精确到0.1)。
试验编号 | 待测NaHSO3溶液的体积/ mL | KMnO4溶液体积/ mL |
1 | 20.00 | 15.98 |
2 | 20.00 | 17.00 |
3 | 20.00 | 16.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某澄清透明溶液中只可能含有①Al3+,②Mg2+,③Fe3+,④Fe2+,⑤H+,⑥CO32-,⑦NO3-中的几种,向该溶液中逐滴加入NaOH溶液至过量,生成沉淀的质量与NaOH的物质的量的关系如图所示.则该溶液中一定含有的离子是![]()

A.⑤⑥⑦B.②③⑤⑦C.①②③⑥⑦D.①②③④⑤⑦
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com