
科目:高中化学 来源: 题型:




查看答案和解析>>
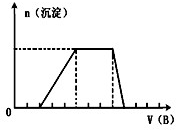
科目:高中化学 来源: 题型:
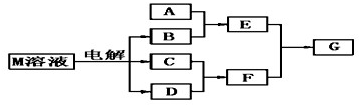
 (4)若A是一种常见的化肥,式量为79,且E与F生成G时有白烟产生,则A的化学式
(4)若A是一种常见的化肥,式量为79,且E与F生成G时有白烟产生,则A的化学式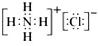
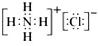
查看答案和解析>>
科目:高中化学 来源: 题型:
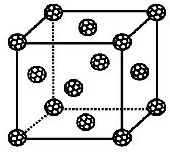 【化学-物质结构与性质】
【化学-物质结构与性质】查看答案和解析>>
科目:高中化学 来源: 题型:
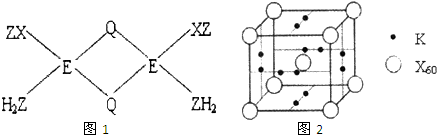 已知X、Y、Z、Q、E五种元素的原子序数依次增大,其中X原子核外电子有6种不同的运动状态,s能级电子数是P能级电子数的两倍;Z原子L层上有2对成对电子;Q是第三周期中电负性最大的元素;E+的M层3d轨道电子全充满.请回答下列问题:
已知X、Y、Z、Q、E五种元素的原子序数依次增大,其中X原子核外电子有6种不同的运动状态,s能级电子数是P能级电子数的两倍;Z原子L层上有2对成对电子;Q是第三周期中电负性最大的元素;E+的M层3d轨道电子全充满.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 | 相关信息 |
| X | X的一种核素质量数为14,中子数为7 |
| Y | Y的过氧化物是一种淡黄色固体,可用作供氧剂 |
| Z | Z的基态原子M层电子数比L层少2个 |
| W | W的基态原子的价电子排布式为3d104sl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com