
����Ŀ���±��������ֶ�����Ԫ�ص������Ϣ��
Ԫ�� | �����Ϣ |
A | ���¡���ѹ�£��䵥������������壬������Ϊ�������������ȼ�� |
B | ��ҵ��ͨ������Һ̬��������䵥�ʣ���ij��ͬ���������DZ�������ر���������Ҫ���� |
C | ֲ��������Ҫ��֮һ�������γɶ��������ijЩ���������ɹ⻯ѧ��Ⱦ |
D | �������䵥��Ϊ����ɫ��ĩ״���壬�������ۻ����õ�����������ȼ�գ���������������ɫ���� |
E | �������䵥��Ϊ����ɫ���壬�䵥��ˮ��Һ��Ư�ס�ɱ������ |
�밴Ҫ��ش��������⣺
��1��DԪ�غ�������Ų� ��
��2��A��B��Ԫ���γɵĺ��зǼ��Լ��Ļ�����Ľṹʽ ��A��B��Ԫ���γɵľ�����ͬ�������������У��ѧʽ����______________��_____________��
��3��C��A�γɵ�ijһ�������ܺ�C��B�γɵ���һ��ɫ������(�����ֻ����������ԭ�Ӹ����Ƚ�Ϊ1��2)һ������������Ƽ������߷�����Ӧ���������ʣ�д��������ѧ��Ӧ����ʽ�� ��
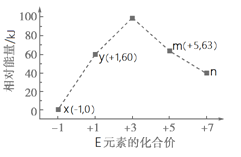
��4��һ�������£���ˮ��Һ��1 mol E����EO(x��1,2,3,4)������(kJ)��Դ�С����ͼ��ʾ��n�� (�����ӷ���)�����ӷ�Ӧy��x��m���Ȼ�ѧ����ʽΪ ��
��5��Na2DB3ˮ��Һ�и�����Ũ�ȵĴ�С˳���� �������ӷ��ţ�
���𰸡���1��![]()
��2��H-O-O-H�� OH����H3O+
��3��2N2H4+N2O4==3N2+4H2O
��4��ClO4����3ClO��(aq)= 2Cl��(aq) +ClO3��(aq) ��H����117 kJ��mol-1
��5��Na+>SO32->OH->HSO3->H+
�����������������A��B��C��DΪ������Ԫ�أ�������ȼ�ղ���Ϊˮ���DZ������������ȼ�ϣ���AΪH������Һ̬�����ɵõ������������������ܱ�������ر���������BΪO��C��ֲ���������ֱ���Ԫ��֮һ�������γɶ�������������γɶ�����������⻯������ѧ��ѧ��ѧϰ��Ψһ�ļ������壬��ʹʪ��ĺ�ɫʯ����ֽ��������CΪN��������D�ĵ��ʳʷ�ĩ״���壬�������ۻ����õ�����������ȼ�գ���������������ɫ���棬��DΪS��E�������䵥��Ϊ����ɫ���壬�䵥��ˮ��Һ��Ư�ס�ɱ�����ã���EΪCl����1��DΪS����������Ų�![]() ����2��A��B��Ԫ���γɵĺ��зǼ��Լ��Ļ�����������⣬��ṹʽΪH-O-O-H���⡢����Ԫ���γɵľ�����ͬ��������������OH-��H3O+����3���������γɵ�ijһ������N2H4�ܺ͵������γɵ���һ��ɫ������N2O4�����߷�����Ӧ�����������ǵ�������Ӧ����ʽΪ��2N2H4+N2O4�T3N2+4H2O����4��n����+7�۵����ӷ���Ϊ��ClO4-�����ӷ�Ӧy��x+m��y��������������ԭ��Ӧ����x��m������ת�Ƶ����غ�ø÷�Ӧ����ʽΪ3ClO-=ClO3-+2Cl-����Ӧ��=��63kJ/mol+2��0kJ/mol��-3��60kJ/mol=-117kJ/mol����5��Na2SO3ˮ��Һ�ʼ��ԣ���Һ�и�����Ũ�ȵĴ�С˳����Na+��SO32-��OH-��HSO3-��H+��
����2��A��B��Ԫ���γɵĺ��зǼ��Լ��Ļ�����������⣬��ṹʽΪH-O-O-H���⡢����Ԫ���γɵľ�����ͬ��������������OH-��H3O+����3���������γɵ�ijһ������N2H4�ܺ͵������γɵ���һ��ɫ������N2O4�����߷�����Ӧ�����������ǵ�������Ӧ����ʽΪ��2N2H4+N2O4�T3N2+4H2O����4��n����+7�۵����ӷ���Ϊ��ClO4-�����ӷ�Ӧy��x+m��y��������������ԭ��Ӧ����x��m������ת�Ƶ����غ�ø÷�Ӧ����ʽΪ3ClO-=ClO3-+2Cl-����Ӧ��=��63kJ/mol+2��0kJ/mol��-3��60kJ/mol=-117kJ/mol����5��Na2SO3ˮ��Һ�ʼ��ԣ���Һ�и�����Ũ�ȵĴ�С˳����Na+��SO32-��OH-��HSO3-��H+��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ʼ��仯�����ڹ�ũҵ������������Ҫ��Ӧ�á���ش�����������
��1��һ��ú̿������������Ԫ����CaSO4���γɹ̶���������������CO�ֻ���CaSO4������ѧ��Ӧ����ص��Ȼ�ѧ����ʽ���£�
��CaSO4��s��+CO��g��![]() CaO��s��+SO2��g��+CO2��g����H = +210.5kJmol-1
CaO��s��+SO2��g��+CO2��g����H = +210.5kJmol-1
��1/4CaSO4��s��+CO��g��![]() 1/4CaS��s��+CO2��g�� ��H = - 47.3kJmol-1
1/4CaS��s��+CO2��g�� ��H = - 47.3kJmol-1
��ӦCaO(s)+3CO(g)+SO2(g) ![]() CaS(s)+3CO2(g) ��H= kJmol-1��
CaS(s)+3CO2(g) ��H= kJmol-1��
ƽ�ⳣ��K������ʽΪ ��
��2��ͼ1Ϊ���ܱ�������H2S����ֽ�����H2��S2(g)��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��
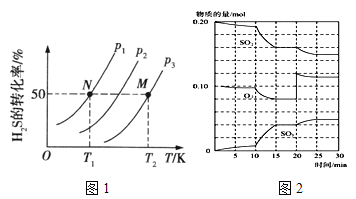
ͼ1��ѹǿp1��p2��p3�Ĵ�С˳��Ϊ �������� ���÷�Ӧƽ�ⳣ���Ĵ�С��ϵΪK(T1) K(T2) (�>������<����=��)�������� ��
��3����һ�������£���������������������·�Ӧ��2SO2(g)��O2(g) ![]() 2SO3(g) ��H��0
2SO3(g) ��H��0
��600��ʱ����һ�ܱ������У������������������ϣ���Ӧ������SO2��O2��SO3���ʵ����仯��ͼ2����Ӧ����ƽ��״̬��ʱ����� ��
����ͼ2�жϣ���Ӧ������20minʱ�����߷����仯��ԭ���� �������ֱ����10min��15min�����߱仯��ԭ������� ����д��ţ���
A�����˴��� B����С�������
C�������¶� D������SO3�����ʵ���
��4�������е�SO2����ijŨ��NaOH��Һ���յõ�Na2SO3��NaHSO3�����Һ����������Һ�����ԣ�����Һ��c(Na��)= ���ú�����Ũ�ȵĴ���ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��50ml0��50mol��L-1������50mL0��55mol��L-1NaOH��Һ������ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ�����зų��������ɼ����к��ȡ��ش��������⣺
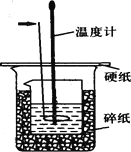
��1����ͷ��ָ������������ �������� ��
��2��ʵ�����õ�NaOH��Һ�����������ͬ����Ũ��ȴ��������ԭ���� ��
��3������ͬŨ�Ⱥ�����Ĵ������HCl��Һ��������ʵ�飬�ų��������� ��������ƫ������ƫС��������Ӱ����������õ���H�� ������ƫ������ƫС��������Ӱ��������
��4����ͼ��ʾʵ��װ�ô�����һ������������� ��
��5��ʵ�����к�����H =" -" 57.3 kJ��mol�C1��������������ʧ����������ʵ��ǰ���¶ȵIJ�ֵ��t ������һλС����ˮ�ı�����c=4.18J/��g������������Һ���ܶȽ���ȡ1g/ml ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��G��ǰ�����ڳ�ϡ������֮��ԭ�������������������Ԫ�ء�A������Ԫ�ؼȲ�ͬ�����ֲ�ͬ�壻B��C�ļ۵��Ӳ���δ�ɶԵ���������2��E�����s��p�ܼ��ĵ���������ȣ�F��Eͬ�����ҵ�һ�����ܱ�EС��G�ģ�1�����ӣ�G+���ĸ������ȫ�������ش��������⣺
��1��B�ĺ�������� �ֿռ��˶�״̬��д��F����Χ�����Ų�ͼ�� ��
��2�����ݵȵ�����ԭ����д��B22-���ӵĵ���ʽ�� ��
��3�����ݼ۲���ӶԻ�������(VSEPR)�Ʋ⣺A2C��VSEPRģ�����ƣ� ��
��4���ڲⶨA��D�γɵĻ��������Է�������ʱ��ʵ��ⶨֵһ���������ֵ����Ҫԭ���� ��
��5��C��SiΪͬһ�����Ԫ�أ�CO2��SiO2��ѧʽ���ƣ����ṹ�������кܴ�ͬ��CO2��C��Oԭ�Ӽ��γ� ������ ������SiO2��Si��Oԭ�Ӽ䲻�γ�������������ԭ�Ӱ뾶��С�ĽǶȷ�����Ϊ��C��Oԭ�Ӽ����γɣ���Si��Oԭ�Ӽ䲻���γ��������� ��
��6��E��һ�־���ṹ��ͼ�ף�����һ�������к��� ��E��G��D�γɵĻ�����ľ����ṹ��ͼ�ң��������ܶ�Ϊag/cm3����G��D����ľ���Ϊ pm���������ӵ�������NA��ʾ���г��������ʽ�����û���������ΪG����ΪD����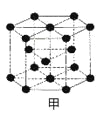
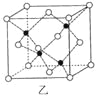
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ԭ���������������X��Y��Z��G��Q��R��T����Ԫ�أ��˵������С��36����֪X��Y��Z��Ԫ�صĻ�̬ԭ��2p�ܼ����е����ӣ������Ӹ����ֱ���2��3��2��G��Tԭ���������18��TԪ�������ڱ���ds���ĵ�һ��Ԫ�أ�Qԭ��s�ܼ���p�ܼ���������ȣ�R������������ּ���������Ӳ�Ʒ�ĺ��IJ��ϡ�
��1��Yԭ�Ӻ����________�ֲ�ͬ�˶�״̬�ĵ��ӣ�TԪ�ػ�̬ԭ����________�ֲ�ͬ�ܼ��ĵ��ӡ�________����״��ͬ��ԭ�ӹ����
��2��X��Y��Z�ĵ縺���ɴ�С��˳��Ϊ________��G��Q��R��һ��������С�����˳��Ϊ________(��Ԫ�ط��ű�ʾ)��
��3��YԪ�ػ�̬ԭ�ӵĵ����Ų�ͼ________��TԪ�ػ�̬ԭ�ӵļ۵����Ų�ʽ________��
��4��XZ2�ĵ���ʽΪ________���õ��뷽��ʽ��ʾY������⻯���ˮ��Һ�ʼ��Ե�ԭ��________��
��5��+1����̬��������ʧȥһ�������γ�+2����̬��̬����������Ҫ��������Ϊ�ڶ�������I2�����λ���I3��I4��I5���������Ʋ�GԪ�صĵ�����ͻ��Ӧ�����ڵ�________�����ܡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���̷���FeSO47H2O��������ȱ����ƶѪ����Чҩ��ij��ѧ��ȤС����̷����������µ�̽����
I .���Ʊ���Ʒ��

��С���ɷ���м������������ͭ�������������ʣ�������ͼ��ʾװ���Ʊ�FeSO4��7H2O���壬�������£�
��1��Ԥ�������Ƚ�����м���뵽����Na2CO3��Һ��ϴ�ӣ�Ŀ���� ��Ȼ����м��ˮϴ��2��3�顣
��2����ϴ�Ӻ�ķ���м���뵽Բ����ƿ�У�������ͨ��N2��N2�������� ��
��3���ټ�������ϡ���ᣬ�����¶�50��~80��֮�䣬��ַ�Ӧ��Բ����ƿ��ʣ��Ĺ���Ϊ ��
��4����ȡ��Ʒ�������裨3���з�Ӧ��Ļ�����м�����������ˮ�����ȹ��ˣ� _______________���˳����壬��������ˮϴ��2��3�Σ�������ֽ���������ɣ��ܱձ��档
II.���ⶨFeSO47H2O������
��1����ȡ������Ʒ10.0g������������ϡ�����У����100mL��Һ����Ҫ����������ƽ����ͷ�ιܡ��ձ�����Ͳ�⣬����Ҫ�������У����������ƣ�____________________��_______________________��
��2��ȷ��ȡ25mL��Һ������ƿ�У���0.1000mol/L KMnO4����Һ�ζ�����ζ��յ���жϷ�����______________________________________________��
��3����ͬ���ķ����ζ�3�Σ�ƽ������10.00mL��Һ������Ʒ��FeSO4��7H2O����������Ϊ ��
����֪Mr(FeSO4��7H2O)=278��
��4�����������ƫС����������ڶ���ʱ_________________(����ӡ������ӡ�)������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС����������װ����ȡ��̽�����������ʡ�
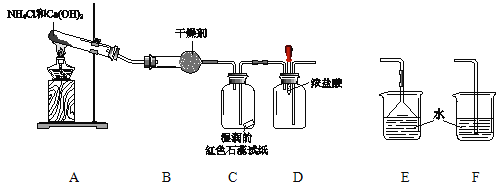
��1��A�з�Ӧ�Ļ�ѧ����ʽ�� ��
��2��B�еĸ������ ��
��3��C������� ��
��4��ʵ�����һ��ʱ���ѹDװ���еĽ�ͷ�ιܣ�����1��2��Ũ���ᣬ�ɹ۲쵽�������� ��
��5��Ϊ��ֹ�����������ݣ���Ҫ������װ�õ�ĩ������һ��β������װ�ã�Ӧѡ�õ�װ���� ���E����F������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��i.������ͼװ�ÿ���֤ͬ����Ԫ�طǽ����Եı仯����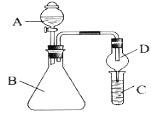
��1������A������Ϊ______�������D��������______��
��2����Ҫ֤���ǽ����ԣ�C1>I����A�м�Ũ���ᣬB�м�______�������ƣ���C�мӵ���-�⻯����Һ���۲쵽C����Һ______��������֤�����ӻ��������Ĺ۵� ����װ�õIJ���֮����_________��
��3����Ҫ֤���ǽ����ԣ�C>Si������A�м����ᣬB�м�CaCO3��C�м�_________�����Լ�������֤������ͬѧ��Ϊ�˷����в���֮����Ӧ��B��D��װ�ü��װ��_________�����Լ�����ϴ��ƿ��
ii������Na��Mg��Al�й㷺��Ӧ��
��4������Na��Mg��Al�Ľ����ԣ�����������ʵ�飺
ʵ��1����ȡ1.0g�����ƺ�þ���ֱ���뵽5mLˮ�У�����˭��Ӧ���ң�þ��ˮ��Ӧ������
ʵ��2����ȡ1.0g��þ�����������ֱ���뵽5mL1.0mol/L�����У�þ�����ᷴӦ���ң��������ᷴӦ�Ͼ��ҡ�
ʵ��1��ʵ��2�ó��Ľ�����_________����ԭ�ӽṹ���۽��ͣ�ͬ����Ԫ�ش����ң�_________��
��5��Na��Mg��Al���������Ʊ�����Ľ����⻯�
�� NaH�����ӻ���������ʽΪ_________������ˮ����������ԭ��Ӧ����H2���÷�Ӧ�Ļ�ԭ����_________��NaH����ˮ�����¿���ΪijЩ������Ʒ�������������ijɷֱ�ʾΪFe2O3����������̷�����Ӧ�Ļ�ѧʽΪ_________��
�� NaAlH4��һ�����õĴ�����ϡ�NaAlH4��ˮ��Ӧ�Ļ�ѧ����ʽ��_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о���ѧϰС�������һ��ʵ����̽��Ԫ�������ɡ�
����ͬѧ�� �������ͼ1װ����һ���������֤�ǽ�����S>C>Si��ʵ���о���
����ͬѧ�� �������ͼ2װ������֤±��Ԫ�����ʵĵݱ���ɡ�
A��B�����ֱ��ǽ���NaBr��Һ������ʪ��ĵ���KI��ֽ��

��1������ͬѧ���ʵ��������� ��
�� A��Һ�������� ��
�� �ձ���C������Ӧ�����ӷ���ʽΪ ��
��2����ͬѧ��ʵ��ԭ����ͨ���۲첣�����е�ʵ��������֤±��Ԫ�����ʵĵݱ䡣
�� д��A��������Ӧ�����ӷ���ʽ ��
�� B����ʵ������Ϊ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com