
【题目】中科院科学家设计出-套利用SO2和太阳能综合制氢方案,其基本工作原理如图所示,下列说法错误的是( )
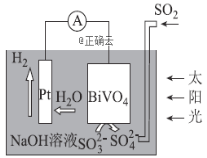
A.该电化学装置中,Pt电极作正极
B.BiVO4电极上的反应式为![]()
C.电子流向:Pt电极→导线→BiVO4电极→电解质溶液→Pt电极
D.OH-移向BiVO4电极
【答案】C
【解析】
该装置为原电池,由Pt电极上反应(H2O→H2)或BiVO4电极上反应(SO32-→SO42-)可知,Pt电极为正极,氢离子得电子生成氢气、发生还原反应,电极反应为2H2O+2e-═H2↑+2OH-;BiVO4电极为负极,SO32-失电子生成硫酸根、发生氧化反应,电极反应为4OH-+SO2-2e-═SO42-+2H2O,原电池工作时,电子由负极BiVO4电极经过导线进入正极Pt电极,据此分析解答。
A.Pt电极上发生还原反应,Pt电极作正极,故A正确;
B.BiVO4电极为负极,发生氧化反应,电极反应式为SO32--2e-+2OH-═SO42-+H2O,故B正确;
C.电子从BiVO4电极(负极)经导线流向Pt电极(正极),但不能进入溶液,故C错误;
D.Pt电极为正极,BiVO4电极为负极,阴离子流向负极,故D正确。
故答案为C。


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:
【题目】如图是一个化学过程的示意图,回答下列问题:
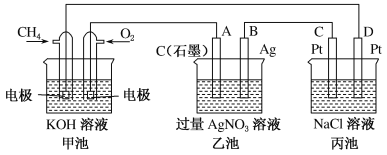
(1)甲池是_____装置,乙装置中电极A的名称是______。
(2)甲装置中通入CH4的电极反应式为_____,乙装置中电极B(Ag)的电极反应式为_____,丙装置中D极的产物是_____(写化学式)。
(3)一段时间,当丙池中产生112 mL(标准状况下)气体时,均匀搅拌丙池,所得溶液在25℃时的pH=_____。(已知:NaCl溶液足量,电解后溶液体积为500 mL)。若要使丙池恢复电解前的状态,应向丙池中通入_______(写名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据核外电子的排布特点推断元素的性质:
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其基态原子的电子排布图为_____,在周期表中位于___区。
(2) B元素基态原子的M层全充满,N层没有成对电子且只有一个未成对电子,B的基态原子的价层电子排布式为_______。
(3)请利用电子排布的相关知识稳定性:Fe3+______Fe2+(填>或< ),原因___________,第一电离能:Mg____Al(填>或< )原因__________。
(4) 有以下物质:①H2 ②N2 ③CO2 ④N2H4⑤H2O2 ⑥HCN(H—C≡N);只有σ键的是______;既有σ键又有π键的是__________;含有由两个原子的s轨道重叠形成的σ键的是_____;含有由一个原子的s轨道与另一个原子的p轨道重叠形成的σ键的是______;
(5) 通过 (3)的解答,请归纳基态原子核外电子排布除了符合构造原理外,泡利原理、洪特规则外,还有哪些结构稳定__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置或操作能达到实验目的的是( )
A.装置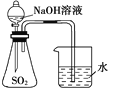 可用于证明
可用于证明![]() 与NaOH溶液发生了反应
与NaOH溶液发生了反应
B.装置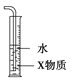 中X为
中X为![]() ,可用于吸收氨或氯化氢
,可用于吸收氨或氯化氢
C.装置 可用于实验室从食盐水中提取氯化钠
可用于实验室从食盐水中提取氯化钠
D.装置 可用于证明浓硫酸与乙醇共热生成乙烯
可用于证明浓硫酸与乙醇共热生成乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为增强铝的耐腐蚀性,现以铅蓄电池为外电源(左池),以Al作阳极、Pb作阴极,电解稀硫酸(右池),使铝表面的氧化膜增厚。反应原理如下:
电池:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l);
电解池:2Al+3H2O ![]() Al2O3+3H2↑。
Al2O3+3H2↑。
关闭K,电解过程中,以下判断正确的是

A. 两池中H+均移向Pb电极
B. 左池每消耗3 mol Pb,右池生成2 mol Al2O3
C. 左池Pb电极质量增加,右池Pb电极质量不变
D. 左池正极反应:PbO2+4H++2e-=Pb2++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式及其叙述正确的是( )
A.氢气的燃烧热为285.5 kJmol-1,则水电解的热化学方程式为:2H2O(l)![]() 2H2(g)+O2(g)
2H2(g)+O2(g) ![]() H=+285.8kJmol-1
H=+285.8kJmol-1
B.1mol甲烷完全燃烧生成CO2 (g)和H2O(l)时放出890kJ热量,它的热化学方程式为 1/2CH4(g)+O2(g) ![]() 1/2CO2(g)+H2O(l)
1/2CO2(g)+H2O(l) ![]() H=-445kJmol-1
H=-445kJmol-1
C.已知2C(s)+O2(g) ![]() 2CO(g)
2CO(g) ![]() H=-221kJmol-1,则C的燃烧热为110.5 kJmol-1
H=-221kJmol-1,则C的燃烧热为110.5 kJmol-1
D.HF与NaOH溶液反应:H+(aq)+OH-(aq) = H2O(l) ![]() H=-57.3kJmol-1
H=-57.3kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(共7分)依据氧化还原反应:
2Ag+(aq) + Cu(s) = Cu2+(aq) + 2Ag(s)设计的原电池如图所示。请回答下列问题:

(1)电极X的材料是 ;电解质溶液Y是 ;
(2)银电极为电池的 极,发生的电极反应为 ;
X电极上发生的电极反应为 ;
(3)外电路中的电子是从 电极流向 电极(填电极材料名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室在50~60℃下制备硝基苯的反应装置如图所示。下列有关说法错误的是( )

A.长玻璃导管的作用是冷凝回流、平衡压强
B.加入试剂的顺序:先加浓硝酸,再加浓硫酸,冷却后加入苯
C.将反应后的液体倒入烧杯中,加水
D.为了除去在硝基苯中的酸性物质,需要水洗、碱洗,然后再水洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,pH=1的某溶液中还含有 Na+、Fe3+、Fe2+、I-、Cl-、CO32-中的若干种,现取100mL 该溶液进行实验(不考虑实验操作过程中物质质量的损失,忽略溶液体积变化):①向该溶液中通入过量氯气,充分反应后加入CCl4进行萃取分液,得到水层和紫色有机层;②向实验①得到的水层,加入足量的NaOH溶液,产生沉淀,过滤,得到的沉淀进行洗涤、灼烧后得到1.60g固体;③向实验②所得滤液中加入硝酸银溶液和稀硝酸,产生白色沉淀;④向实验①所得到的紫色有机层,进行一系列操作后,得到2.54g紫黑色固体。根据实验结果,下列判断正确的是
A.不能确定Na+和Cl-是否存在,CO32-一定不存在
B.Fe2+、I-、Cl-三种离子一定存在
C.Fe3+、Fe2+至少有一种
D.该溶液中c(Cl-)≥0.1mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com