
【题目】常温下,pH=1的某溶液中还含有 Na+、Fe3+、Fe2+、I-、Cl-、CO32-中的若干种,现取100mL 该溶液进行实验(不考虑实验操作过程中物质质量的损失,忽略溶液体积变化):①向该溶液中通入过量氯气,充分反应后加入CCl4进行萃取分液,得到水层和紫色有机层;②向实验①得到的水层,加入足量的NaOH溶液,产生沉淀,过滤,得到的沉淀进行洗涤、灼烧后得到1.60g固体;③向实验②所得滤液中加入硝酸银溶液和稀硝酸,产生白色沉淀;④向实验①所得到的紫色有机层,进行一系列操作后,得到2.54g紫黑色固体。根据实验结果,下列判断正确的是
A.不能确定Na+和Cl-是否存在,CO32-一定不存在
B.Fe2+、I-、Cl-三种离子一定存在
C.Fe3+、Fe2+至少有一种
D.该溶液中c(Cl-)≥0.1mol·L-1
【答案】B
【解析】
pH=1的溶液中存在大量氢离子,则一定不存在CO32-;向溶液中通入氯气分液后得到紫色溶液,则原溶液中含有I-,铁离子能够氧化碘离子,则一定不存在Fe3+;水层中加入氢氧化钠溶液得到固体,该固体为氢氧化铁,灼烧固体得到的1.60g为氧化铁,则溶液中一定存在Fe2+,然后结合碘单质的质量、氧化铁的质量及电荷守恒判断氯离子的存在情况及浓度。
pH=1的溶液中氢离子浓度c(H+)=0.1mol/L,该溶液中含有大量H+,则一定不存在CO32-;
向溶液中通入氯气分液后得到紫色溶液,则原溶液中含有I-,Fe3+能够氧化I-,则一定不存在Fe3+;2.54g为碘单质,其物质的量n(I2)=![]() =0.01mol,则原溶液中含有I-的物质的量为n(I-)=2n(I2)=0.02mol;
=0.01mol,则原溶液中含有I-的物质的量为n(I-)=2n(I2)=0.02mol;
水层中加入氢氧化钠溶液得到固体,该固体为Fe(OH)3,灼烧固体得到的1.60g固体为Fe2O3,则溶液中一定存在Fe2+,根据铁元素守恒可知n(Fe2+)=2n(Fe2O3)![]() ×2=0.02mol,根据电荷守恒,0.02mol Fe2+带有正电荷为0.04mol,0.02mol I-带有0.02mol电荷,H+还带有0.01mol正电荷,0.04mol+0.01mol>0.02mol,所以原溶液中一定含有Cl-,其物质的量至少为0.04mol-0.02mol+0.01mol=0.03mol,氯离子的浓度最小为
×2=0.02mol,根据电荷守恒,0.02mol Fe2+带有正电荷为0.04mol,0.02mol I-带有0.02mol电荷,H+还带有0.01mol正电荷,0.04mol+0.01mol>0.02mol,所以原溶液中一定含有Cl-,其物质的量至少为0.04mol-0.02mol+0.01mol=0.03mol,氯离子的浓度最小为![]() =0.3mol/L。
=0.3mol/L。
A.原溶液中一定不存在CO32-,一定含有Cl-,A错误;
B.根据上述分析计算可知,原溶液中一定有Fe2+、I-、Cl-三种离子,B正确;
C.原溶液中一定存在Fe2+,一定不存在Fe3+,C错误;
D.根据分析可知该溶液中c(Cl-)≥0.3nol/L,D错误;
故合理选项是B。


科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分是Al2O3,还有少量的Fe2O3、SiO2)提取冶炼铝的原料氧化铝。工艺流程如图,下列有关说法正确的是

A.该流程中,原料A可以是盐酸,也可以是氢氧化钠溶液
B.步骤2 中要发生的反应有:Fe3++3OH-=Fe(OH)3↓、Al3++4OH-=[Al(OH)4] -、H++OH-=H2O
C.滤液3中的主要离子有碳酸根、钠离子、氯离子
D.工业上冶炼铝用氧化铝不用氯化铝的原因是,氧化铝是电解质,氯化铝是非电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】改变0.1 mol·L-1二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图所示[已知![]() ]。下列叙述不正确的是( )
]。下列叙述不正确的是( )

A.NaHA溶液中,HA-的水解能力小于HA-的电离能力
B.lg[K2(H2A)]=-4.2
C.将等物质的量的NaHA和Na2A混合物溶于水,所得的溶液中α(HA-)=α(A2-)
D.0.1 mol·L1 NaHA溶液中:c(Na+)+c(A2)+c(H2A)+c(HA)=0.2 mol·L1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在体积为2 L的密闭容器中混合,并在一定条件下发生反应:2A(g)+B(g) ![]() xC(g),若经2 s后测得A的物质的量为2.8 mol,C的物质的量浓度为0.6 mol/L。求:
xC(g),若经2 s后测得A的物质的量为2.8 mol,C的物质的量浓度为0.6 mol/L。求:
①2 s内用物质A表示的平均反应速率为________________。
②2 s内用物质B表示的平均反应速率为__________________________。
③2 s时物质B的转化率为______________________。
④x=________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含苯酚的工业废水的处理流程如图所示。
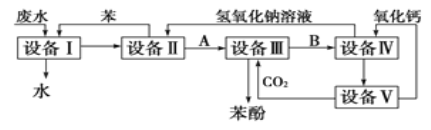
(1)流程图设备Ⅰ中进行的是________操作(填写操作名称)。
(2)由设备Ⅱ进入设备Ⅲ的物质A是________(填化学式,下同)。由设备Ⅲ进入设备Ⅳ的物质B是________。
(3)在设备Ⅳ中,物质B的水溶液和CaO反应后,产物是NaOH、H2O和________。通过________(填操作名称)操作,可以使产物相互分离。
(4)图中,能循环使用的物质是________、________、NaOH和CaO(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素原子序数与主要化合价的关系图,X、Y、Z、W、R是其中的五种元素。下列说法不正确的是

A.离子半径:Y>X
B.33号砷元素与Q同族
C.最高价氧化物的水化物的酸性:R>W
D.单质与水(或酸)反应的剧烈程度:Y>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为周期表中短周期的一部分,若X原子最外层电子数比次外层电子数少3,则下列说法正确的是( )

A. X的氢化物比R的氢化物稳定
B. 原子半径大小顺序是Z>Y>X
C. Y、R形成的化合物YR2能使KMnO4溶液褪色
D. X、Z可形成化合物XZ5 , 分子中各原子均满足最外层8电子结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中的每一个方格表示有关的一种反应物或生成物,其中X为正盐,A、C、D均为无色气体。

(1)写出有关的物质化学式。X: C: E: F:
(2)写出反应①的化学方程式_____________________________________
(3)写出反应②的离子方程式_____________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,甲容器中充满35Cl2,乙容器中充满37Cl2,下列叙述不正确的是
A. 若两种气体体积相等,甲、乙两容器中气体的密度之比为35∶37
B. 若两种气体体积相等,甲、乙两容器中气体分子数之比为35∶37
C. 若两种气体质量相等,甲、乙两容器中气体所含质子数之比为37∶35
D. 若两种气体体积相等,甲、乙两容器中气体所含中子数之比为9∶10
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com