
【题目】含苯酚的工业废水的处理流程如图所示。
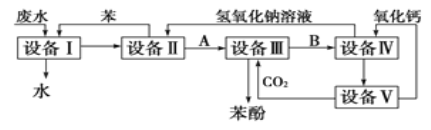
(1)流程图设备Ⅰ中进行的是________操作(填写操作名称)。
(2)由设备Ⅱ进入设备Ⅲ的物质A是________(填化学式,下同)。由设备Ⅲ进入设备Ⅳ的物质B是________。
(3)在设备Ⅳ中,物质B的水溶液和CaO反应后,产物是NaOH、H2O和________。通过________(填操作名称)操作,可以使产物相互分离。
(4)图中,能循环使用的物质是________、________、NaOH和CaO(填化学式)。
【答案】萃取 C6H5ONa NaHCO3 CaCO3 过滤 C6H6 CO2
【解析】
(1)①从含苯酚的工业废水与苯进入设备Ⅰ得到无酚工业废水(此废水可以排放),说明在设备Ⅰ中进行的是萃取,利用苯与苯酚具有相似的结构,将苯酚从工业废水里抽提出来,用分液的方法将下层的工业废水放出排放,上层的苯酚苯溶液进入设备Ⅱ;
故答案为萃取;
(2)设备Ⅱ中向苯酚和苯的混合液中加入NaOH溶液,目的是分离出苯,故A物质是苯酚钠溶液;在设备Ⅲ中通入CO2分离出苯酚,故剩下物质B是NaHCO3溶液;
故答案为C6H5ONa;NaHCO3;
(3)在设备Ⅳ中向NaHCO3溶液中加入CaO,生成NaOH、H2O、CaCO3,可用过滤操作分离出CaCO3;
故答案为CaCO3;过滤;
(4)根据流程图,盛有苯酚苯溶液的设备Ⅱ中注入氢氧化钠溶液,此时,具有酸性的苯酚跟氢氧化钠发生中和反应,生成苯酚钠和水,![]() ,苯酚钠是离子化合物,易溶于水中。伴随上述化学反应的发生,在设备Ⅱ中的液体分为两层,上层是苯层,下层是苯酚钠的水溶液(即设问中的物质A),上层的苯通过管道送回设备Ⅰ中继续萃取工业废水中的苯酚,循环使用,下层的苯酚钠(A)溶液进入设备(Ⅲ)。根据流程图,下一步在盛有苯酚钠溶液的设备Ⅲ中,通入过量的二氧化碳气体,这两种物质间发生化学反应,生成苯酚和碳酸氢钠,H2CO3的酸性比苯酚的酸性强,化学方程式如下:
,苯酚钠是离子化合物,易溶于水中。伴随上述化学反应的发生,在设备Ⅱ中的液体分为两层,上层是苯层,下层是苯酚钠的水溶液(即设问中的物质A),上层的苯通过管道送回设备Ⅰ中继续萃取工业废水中的苯酚,循环使用,下层的苯酚钠(A)溶液进入设备(Ⅲ)。根据流程图,下一步在盛有苯酚钠溶液的设备Ⅲ中,通入过量的二氧化碳气体,这两种物质间发生化学反应,生成苯酚和碳酸氢钠,H2CO3的酸性比苯酚的酸性强,化学方程式如下: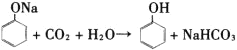 ,在析出的苯酚中含有微量水,呈油状液体,沉于设备Ⅲ液体的下层,经分液后再精馏可得苯酚。上层液体B是NaHCO3溶液,经管道输送进入设备Ⅳ。盛有碳酸氢钠溶液的设备Ⅳ中,加入CaO,生石灰与碳酸氢钠溶液里的水化合变为熟石灰Ca(OH)2,Ca(OH)2与NaHCO3发生复分解反应,生成NaOH和CaCO3沉淀,化学方程式如下:CaO+H2O= Ca(OH)2,Ca(OH)2+NaHCO3= CaCO3↓+NaOH+H2O,若把上述两个反应合并写为下式:CaO+ NaHCO3= CaCO3↓+NaOH。NaOH溶液与CaCO3沉淀通过过滤分离。反应所得NaOH溶液,通过管道进入设备Ⅱ,循环使用;所得CaCO3沉淀进入设备Ⅴ。在设备Ⅴ中的原料是CaCO3固体,所得的产品是氧化钙和二氧化碳,由此可知,设备Ⅴ应是石灰窑,其中,发生的化学反应为:CaCO3
,在析出的苯酚中含有微量水,呈油状液体,沉于设备Ⅲ液体的下层,经分液后再精馏可得苯酚。上层液体B是NaHCO3溶液,经管道输送进入设备Ⅳ。盛有碳酸氢钠溶液的设备Ⅳ中,加入CaO,生石灰与碳酸氢钠溶液里的水化合变为熟石灰Ca(OH)2,Ca(OH)2与NaHCO3发生复分解反应,生成NaOH和CaCO3沉淀,化学方程式如下:CaO+H2O= Ca(OH)2,Ca(OH)2+NaHCO3= CaCO3↓+NaOH+H2O,若把上述两个反应合并写为下式:CaO+ NaHCO3= CaCO3↓+NaOH。NaOH溶液与CaCO3沉淀通过过滤分离。反应所得NaOH溶液,通过管道进入设备Ⅱ,循环使用;所得CaCO3沉淀进入设备Ⅴ。在设备Ⅴ中的原料是CaCO3固体,所得的产品是氧化钙和二氧化碳,由此可知,设备Ⅴ应是石灰窑,其中,发生的化学反应为:CaCO3![]() CaO+CO2↑,反应所得二氧化碳通入设备Ⅲ,反应所得氧化钙进入设备Ⅳ。
CaO+CO2↑,反应所得二氧化碳通入设备Ⅲ,反应所得氧化钙进入设备Ⅳ。
综上所述,在含苯酚工业废水提取苯酚的工艺流程中,苯、氧化钙、氢氧化钠、二氧化碳4种物质均可以循环使用,理论上应当没有消耗。
答案为C6H6、CO2。


科目:高中化学 来源: 题型:
【题目】为探究实验室制乙烯及乙烯和溴水的加成反应。甲同学设计了如图所示的实验装置,并进行了实验。当温度升至170℃左右时,有大量气体产生,产生的气体通入溴水中,溴水的颜色迅速褪去。甲同学认为达到了实验目的。
乙同学仔细考察了甲同学的整个实验过程,发现当温度升到100℃左 右时,无色液体开始变色,到160℃左右时,混合液全呈黑色,在170℃超过后生成气体速度明显加快,生成的气体有刺激性气味。由此他推出,产生的气体中应有杂质,可能影响乙烯的检出,必须除去。据此回答下列问题:

(1)写出甲同学实验中两个反应的化学方程式:_____________、___________________________。
(2)乙同学观察到的黑色物质是_____________,刺激性气体是_____________。乙同学认为刺激性气体的存在就不能认为溴水褪色是乙烯的加成反应造成的。原因是(用化学方程表示):________。
(3)丙同学根据甲乙同学的分析,认为还可能有CO、CO2两种气体产生。为证明CO存在,他设计了如下过程(该过程可把实验中产生的有机产物除净):发现最后气体经点燃是蓝色火焰,确认有一氧化碳。

①设计装置a的作用是____________________
②浓溴水的作用是_______________________,稀溴水的作用是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种可充电锂-空气电池如图所示。当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2-x(x=0或1)。下列说法不正确的是( )
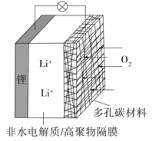
A.放电时,多孔碳材料电极为正极
B.放电时,外电路电子由多孔碳材料电极流向锂电极
C.充电时,电解质溶液中Li+向锂电极迁移
D.充电时,电池总反应为Li2O2-x=2Li+ (1-![]() )O2
)O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某芳香族酯类化合物甲的分子式为C14H10O5,1 mol甲水解后只生成一种产物乙,其物质的量为2 mol,下列说法正确的是( )
A. 符合上述条件的甲共有3种B. 1 mol甲最多可以和3 mol NaOH反应
C. 乙不能和溴水发生反应D. 2 mol乙最多可以和1 mol Na2CO3反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究欲利用甲烷消除NO2污染,CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g)。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见表。
N2(g)+CO2(g)+2H2O(g)。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见表。

下列说法正确的是
A.①组中,0~20min内,用NO2表示的反应速率为0.0125mol·Lˉ1·minˉ1
B.由实验数据可知实验控制的温度T1<T2
C.容器内混合气体的密度不变,说明反应已达到平衡状态
D.若增大压强,则正反应速率加快,逆反应速率减慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,pH=1的某溶液中还含有 Na+、Fe3+、Fe2+、I-、Cl-、CO32-中的若干种,现取100mL 该溶液进行实验(不考虑实验操作过程中物质质量的损失,忽略溶液体积变化):①向该溶液中通入过量氯气,充分反应后加入CCl4进行萃取分液,得到水层和紫色有机层;②向实验①得到的水层,加入足量的NaOH溶液,产生沉淀,过滤,得到的沉淀进行洗涤、灼烧后得到1.60g固体;③向实验②所得滤液中加入硝酸银溶液和稀硝酸,产生白色沉淀;④向实验①所得到的紫色有机层,进行一系列操作后,得到2.54g紫黑色固体。根据实验结果,下列判断正确的是
A.不能确定Na+和Cl-是否存在,CO32-一定不存在
B.Fe2+、I-、Cl-三种离子一定存在
C.Fe3+、Fe2+至少有一种
D.该溶液中c(Cl-)≥0.1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组分子中,都由极性键构成的极性分子的一组是
A. C3H6和CO2 B. CCl4和H2S C. H2O和NH3 D. H2O2和CS2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在恒容容器中投入一定量纯净的氨基甲酸铵,发生下列反应NH2COONH4(s) ![]() 2NH3(g)+CO2(g)。能判断该分解反应已经达到化学平衡的是
2NH3(g)+CO2(g)。能判断该分解反应已经达到化学平衡的是
A.2v(NH3)=v(CO2)
B.密闭容器中混合气体的密度不变
C.密闭容器中混合气体的平均摩尔质量不变
D.密闭容器中氨气的体积分数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用20 mL 18.4 mol/L浓H2SO4和铜共热一段时间后,使反应混合物冷却,滤去多余的铜,将滤液加水定容到100 mL,测得SO42-离子物质的量浓度为3. 18 mol/L。试求溶液中CuSO4的物质的量浓度( )
A. 0.50 mol/L B. 0.75 mol/L C. 1.00 mol/L D. 3.18 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com