
【题目】同温同压下,甲容器中充满35Cl2,乙容器中充满37Cl2,下列叙述不正确的是
A. 若两种气体体积相等,甲、乙两容器中气体的密度之比为35∶37
B. 若两种气体体积相等,甲、乙两容器中气体分子数之比为35∶37
C. 若两种气体质量相等,甲、乙两容器中气体所含质子数之比为37∶35
D. 若两种气体体积相等,甲、乙两容器中气体所含中子数之比为9∶10
【答案】B
【解析】
35Cl2的相对分子质量为70,37Cl2的相对分子质量为74。
A.同温同压下,若两种气体体积相等,由n=![]() =
=![]() 可得ρ=
可得ρ=![]() =
=![]() ,密度与摩尔质量呈正比,甲、乙两容器中气体的密度之比为35∶37,故A正确;
,密度与摩尔质量呈正比,甲、乙两容器中气体的密度之比为35∶37,故A正确;
B.同温同压下,由n=![]() =
=![]() 可知体积与分子数呈正比,若两种气体体积相等,则甲、乙两容器中气体分子数之比为1∶1,故B错误;
可知体积与分子数呈正比,若两种气体体积相等,则甲、乙两容器中气体分子数之比为1∶1,故B错误;
C.若两种气体质量相等,由n=![]() 可知,气体的物质的量与摩尔质量呈反比,则甲、乙两容器中气体的物质的量之比为37∶35,因都由Cl元素组成,则所含质子数之比为37∶35,故C正确;
可知,气体的物质的量与摩尔质量呈反比,则甲、乙两容器中气体的物质的量之比为37∶35,因都由Cl元素组成,则所含质子数之比为37∶35,故C正确;
D.同温同压下,若两种气体体积相等,则两种容器的气体的物质的量相等,甲、乙两容器中气体所含中子数之比为(3517)×2∶(3717)×2=9∶10,故D正确;
答案选B。


科目:高中化学 来源: 题型:
【题目】常温下,pH=1的某溶液中还含有 Na+、Fe3+、Fe2+、I-、Cl-、CO32-中的若干种,现取100mL 该溶液进行实验(不考虑实验操作过程中物质质量的损失,忽略溶液体积变化):①向该溶液中通入过量氯气,充分反应后加入CCl4进行萃取分液,得到水层和紫色有机层;②向实验①得到的水层,加入足量的NaOH溶液,产生沉淀,过滤,得到的沉淀进行洗涤、灼烧后得到1.60g固体;③向实验②所得滤液中加入硝酸银溶液和稀硝酸,产生白色沉淀;④向实验①所得到的紫色有机层,进行一系列操作后,得到2.54g紫黑色固体。根据实验结果,下列判断正确的是
A.不能确定Na+和Cl-是否存在,CO32-一定不存在
B.Fe2+、I-、Cl-三种离子一定存在
C.Fe3+、Fe2+至少有一种
D.该溶液中c(Cl-)≥0.1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科研人员最近发明了一种水电池,这种电池能利用淡水和海水之间的含盐量差进行供电,该电池的化学反应为:5MnO2+2Ag+2NaCl→Na2Mn5O10+2AgCl
(1)简述Na2O熔点比NaCl高的其原因。_______________________
(2)将Al粉和MnO2混合,经高温引发反生反应,写出化学反应方程式。__________________________,若反应中生成5.5kg单质,则转移电子的数目是________个。
(3)元素周期表中,铁(Fe)和锰(Mn)位于同周期。向化合物X的溶液中,滴加NaOH溶液时,发生反应:X+3NaOH→3Y+Fe(OH)3↓。X的化学式可能是________________、________________。
(4)将SO2通入Fe2(SO4)3溶液中,溶液变为浅绿色,且酸性增强,请写出离子方程式。______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为MnO2和浓盐酸共热制取氯气的实验装置,反应为:MnO2+4HCl![]() MnCl2+Cl2+2H2O,请回答下列问题:
MnCl2+Cl2+2H2O,请回答下列问题:

(1)打开活塞K,将分液漏斗中的液体加入烧瓶中,观察D中导管口是否有气泡产生,__(填:能或不能)验证装置的气密性良好;
(2)C中收集到的Cl2中含有HCl,请从分子结构的角度解释其中的原因___;
(3)装置D的作用是___;
(4)B的作用为___(选填下列编号)。
A.洗气瓶 B.储气瓶 C.安全瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用20 mL 18.4 mol/L浓H2SO4和铜共热一段时间后,使反应混合物冷却,滤去多余的铜,将滤液加水定容到100 mL,测得SO42-离子物质的量浓度为3. 18 mol/L。试求溶液中CuSO4的物质的量浓度( )
A. 0.50 mol/L B. 0.75 mol/L C. 1.00 mol/L D. 3.18 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他反应产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C外,另一产物是盐酸盐。
![]()
下列说法中不正确的是( )
A. 当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4
B. 当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3
C. B和Cl2的反应是氧化还原反应
D. 当X是强酸时,C在常温下是气态单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烟道气中的NOx是主要的大气污染物之一,为了监测其含量,选用如下采样和检测方法。回答下列问题:
I.采样
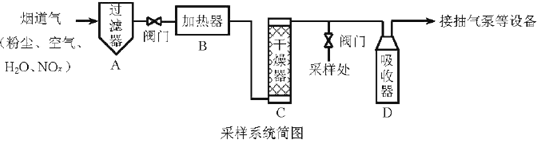
采样步骤:
①检验系统气密性;②加热器将烟道气加热至140。C;③打开抽气泵置换系统内空气;④采集无尘、干燥的气样;⑤关闭系统,停止采样。
II. NOx含量的测定
将VL气样通入适量酸化的H2O2溶液中,使NOx完全被氧化为NO3-,加水稀释至100.00 mL。量取20.00 mL该溶液,加入V1 mL c1 mol·L-1 FeSO4标准溶液(过量),充分反应后,用c2 mol·L-1 K2Cr2O7标准溶液滴定剩余的Fe2+,终点时消耗V2 mL。
(1)NO被H2O2氧化为NO3-的离子方程式是___________。
(2)滴定操作使用的玻璃仪器主要有___________。
(3)滴定过程中发生下列反应:
3Fe2+ +NO3-+4H+ = NO↑+3Fe3+ +2H2O
Cr2O72-+ 6Fe2+ +14H+ =2Cr3+ +6Fe3++7H2O
则气样中NOx折合成NO2的含量为_________mg·m-3。
(4)判断下列情况对NOx含量测定结果的影响(填“偏高” 、“偏低”或“无影响 ”)若缺少采样步骤③,会使测试结果___________。若FeSO4标准溶液部分变质,会使测定结果___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将甲烷与氯气按1:3的体积比混合于一试管中,倒立于盛有饱和食盐水的水槽,置于光亮处(如图所示),下列有关此实验的现象和结论的叙述不正确的是( )
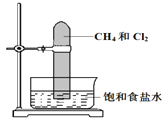
A. 试管中气体的黄绿色逐渐变浅,水面上升
B. 生成物只有三氯甲烷和氯化氢在标准状况下是气体
C. 试管内壁有油状液滴形成
D. 试管内有少量白雾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表中物质间的转化能按如图所示通过一步反应进行的是( )
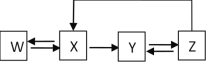
选项物质 | W | X | Y | Z |
A | Ca | CaO | Ca(OH)2 | CaCO3 |
B | S | SO3 | H2SO4 | CaSO4 |
C | Si | SiO2 | Na2SiO3 | H2SiO3 |
D | Fe | Fe2O3 | FeCl3 | Fe(OH)3 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com