
����Ŀ��������ѧ��V��Grignard����������Grignard�Լ���±������þ���㷺�������л��ϳɣ�Grignard�Լ��ĺϳɷ����ǣ�RX+Mg ![]() RMgX��Grignard�Լ��������ɵ�±������þ������ʻ��ṹ�Ļ����ȩ��ͪ�ȣ�������Ӧ����ˮ����ܺϳɸ���ָ���ṹ�Ĵ���
RMgX��Grignard�Լ��������ɵ�±������þ������ʻ��ṹ�Ļ����ȩ��ͪ�ȣ�������Ӧ����ˮ����ܺϳɸ���ָ���ṹ�Ĵ��� 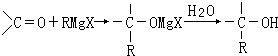
����2����ϩ�ͱ�Ҫ������Ϊԭ�Ϻϳ�3��4��������3�������������ϳ�һ�ַ���ʽΪC10H16O4�ľ�����Ԫ��������J���ϳ���·���£�H��һ�ȴ���ֻ��3�֣�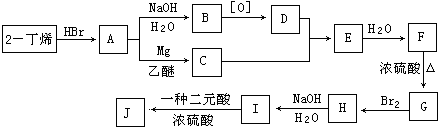
�밴Ҫ����գ�
��1��D�й����ŵ�����Ϊ��F�Ľṹ��ʽ�� ��
��2��C+D��E�ķ�Ӧ������ �� F��G�ķ�Ӧ��������
��3��д�����л�ѧ��Ӧ����ʽ���л������ýṹ��ʽ��ʾ����
A��B ��
I��J ��
��4��������G��һ�������·����Ӿ۷�Ӧ�Ļ�ѧ����ʽΪ ��
���𰸡�
��1���ʻ���![]()
��2���ӳɷ�Ӧ����ȥ��Ӧ
��3��CH3CH2CHBrCH3+NaOH ![]() CH3CH2CH��OH��CH3+NaBr��
CH3CH2CH��OH��CH3+NaBr��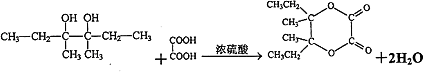
��4��n ![]()
![]()

���������⣺F��3��4��������3���������ṹ��ʽΪ ![]() ��F������ȥ��Ӧ����G��G���巢���ӳɷ�Ӧ����H��H��һ�ȴ���ֻ��3�֣�����GΪ
��F������ȥ��Ӧ����G��G���巢���ӳɷ�Ӧ����H��H��һ�ȴ���ֻ��3�֣�����GΪ ![]() ��HΪ
��HΪ 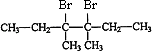 ��H������������Һ����ȡ����Ӧ����IΪ
��H������������Һ����ȡ����Ӧ����IΪ  ��I�Ͷ�Ԫ�ᷢ��������Ӧ����J��C10H16O4��������Ԫ������֪�ö�Ԫ��ΪHOOC��COOH����J�Ľṹ��ʽΪ��
��I�Ͷ�Ԫ�ᷢ��������Ӧ����J��C10H16O4��������Ԫ������֪�ö�Ԫ��ΪHOOC��COOH����J�Ľṹ��ʽΪ�� 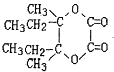 ��2����ϩ��HBr�����ӳɷ�Ӧ����A��A��Mg/���ѷ�Ӧ�õ�C��A����ˮ�ⷴӦ����B��B��������D����ϸ������Ϣ��F�Ľṹ����֪DΪ
��2����ϩ��HBr�����ӳɷ�Ӧ����A��A��Mg/���ѷ�Ӧ�õ�C��A����ˮ�ⷴӦ����B��B��������D����ϸ������Ϣ��F�Ľṹ����֪DΪ ![]() ��CΪ
��CΪ ![]() ����BΪ
����BΪ ![]() ��AΪ
��AΪ ![]() ��
��
��1.��DΪ ![]() �������ŵ�����Ϊ�ʻ���F�Ľṹ��ʽ�ǣ�
�������ŵ�����Ϊ�ʻ���F�Ľṹ��ʽ�ǣ� ![]() ��
��
���Դ��ǣ��ʻ��� ![]() ��
��
��2.��C+D��E�ķ�Ӧ�����ǣ��ӳɷ�Ӧ��F��G�ķ�Ӧ�����ǣ���ȥ��Ӧ��
���Դ��ǣ��ӳɷ�Ӧ����ȥ��Ӧ��
��3.��A��B�ķ�Ӧ����ʽΪ��CH3CH2CHBrCH3+NaOH ![]() CH3CH2CH��OH��CH3+NaBr��
CH3CH2CH��OH��CH3+NaBr��
I��J�ķ�Ӧ����ʽΪ�� 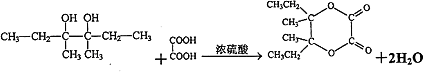 ��
��
���Դ��ǣ�CH3CH2CHBrCH3+NaOH ![]() CH3CH2CH��OH��CH3+NaBr��
CH3CH2CH��OH��CH3+NaBr�� 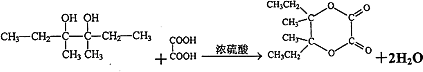 ��
��
��4.��������G��һ�������·����Ӿ۷�Ӧ�Ļ�ѧ����ʽΪ��n ![]()
![]()
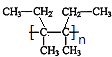 ��
��
���Դ��ǣ�n ![]()
![]()
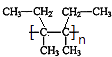 ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڽ�������������˵����ȷ����
A.������Ʒ����Ϳ���´ɿ��Է��������´ɲ�������������ֹ���������
B.��п����Ʒ�����п�������������ֹ�����������
C.���������ů�����ⳣͿ��һ�����࣬����һ�ָı�����ڲ��ṹ�ķ���
D.�ִ����ˮ�����³�װ��һЩп�飬������������������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D�����ֳ����ĵ��ʣ�A��BΪ������C��D�����������壬��DΪ����ɫ���壮�ס��ҡ���Ϊ�����Ļ���������ʾ��д��ԣ�����֮������ͼ��ת����ϵ�� 
��ش��������⣺
��1��B���Ӧ�Ļ�ѧ����ʽ�� �� B��NaOH��Һ��Ӧ�����ӷ���ʽ�� �� ��������������Һ��Ӧ�����ӷ���ʽ�� ��
��2������B�������ӵ���Һ������Һ��Ӧ�õ�һ�ְ�ɫ�������÷�Ӧ�����ӷ���ʽ�� ��
��3��ʵ���Ҽ������Һ���������������ӵIJ��������������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵����ȷ���ǣ� ��
A.2.0gH218O��D2O�Ļ����������������ΪNA
B.���³�ѹ�£�4.4g��ȩ�����Ҽ���ĿΪ0.7 NA
C.��״���£�5.6L CO2������Na2O2��Ӧת�Ƶĵ�����Ϊ0.5 NA
D.50ml 12mol/L����������MnO2���ȣ�ת�Ƶĵ�����Ϊ0.3 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧ�������
��1����������A��B�������ʣ�
A�飺CH3��CHCl��CH3�� ![]() ��HCOOH��CH3COOC2H5 ��
��HCOOH��CH3COOC2H5 ��
B�飺CH3CH2CH2OH��������Һ��KOH��Һ��Na2CO3��Һ�� �Իش�
��A�����ܸ�B�����������ʶ��ɷ�����Ӧ��
��B�����ɸ�A�����������ʷ�Ӧ
��2�������� ![]() ��OH ��CH2=CH2��CH��CH ��
��OH ��CH2=CH2��CH��CH �� ![]() ��CH2OH ��
��CH2OH �� ![]() ��CH3 ��CH3COO��
��CH3 ��CH3COO�� ![]() ��CH3CH2CH2CH2Br
��CH3CH2CH2CH2Br
�����ڷ�����������������ˮ�����ӳɷ�Ӧ�������ܷ�����ȥ��Ӧ����������NaOH��Һ��Ӧ����������Na2CO3��Һ��Ӧ���� �� ����д�������ʵ���ţ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������100mL 1.0mol/L Na2CO3��Һ����ȷ�ķ����ǣ�������
�ٽ�10.6g Na2CO3����100mLˮ��
�ڽ�28.6g Na2CO310H2O��������ˮ�У�����ˮϡ����100mL
�۽�20ml 5.0mol/L Na2CO3��Һ��ˮϡ����100mL��
A.�٢�
B.�ڢ�
C.ֻ�Т�
D.ֻ�Т�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڱ�ǰ�����ڵ�Ԫ��A��B��C��D��E��ԭ��������������A�ĺ����������������������ͬ��B�ļ۵��Ӳ���δ�ɶԵ�����3����C������������Ϊ���ڲ��������3����D��Cͬ�壻E�������ֻ��1�����ӣ����������18�����ӣ��ش��������⣻
��1��B��C��D�е�һ����������������Ԫ�ط��ţ���C�ĵ����Ų�ʽΪ ��
��2��A������Ԫ���γɵĶ�Ԫ���ۻ������У����ӳ������Σ��÷��ӵ�����ԭ�ӵ��ӻ���ʽΪ�������мȺ��м��Թ��ۼ����ֺ��зǼ��Թ��ۼ��Ļ����������ѧʽ����
��3����ЩԪ���γɵĺ������У����ӵ�����ԭ�ӵļ۲���Ӷ���Ϊ3������������������ṹ������ �� ���ѧʽ��
��4��E��C�γɵ�һ�����ӻ�����ľ���ṹ��ͼ��a������E�����ӷ���Ϊ �� 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��Ԫ�����ڱ���һ���֣����е�ÿ����ĸ��ʾһ�ֶ�����Ԫ�أ���ش��������⣺ 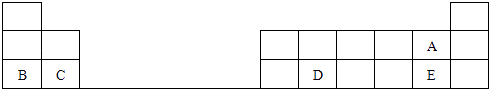
��1��д��D��ԭ�ӽṹʾ��ͼ ��
��2��A��E����Ԫ�����γɵ���̬�⻯��ȶ���HAHE�������������������
��3��B��C��Ԫ�ص�ԭ�Ӱ뾶��BC�������������������
��4����ʢ��ˮ��С�ձ��м���B�ĵ��ʣ�д���÷�Ӧ�Ļ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С�����ݷ�ӦAsO43��+2H++2I��AsO33��+I2+H2O�����ͼ1ԭ��أ�̽��pH��AsO43�������Ե�Ӱ�죮��õ�ѹ��pH�Ĺ�ϵ��ͼ2�������й�����������ǣ� �� 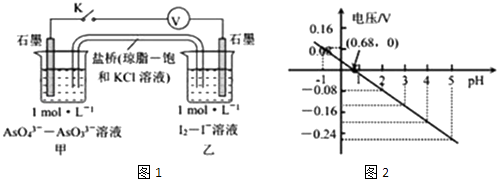
A.pH��0.68ʱ�����ձ���ʯīΪ����
B.pH=0.68ʱ����Ӧ����ƽ��״̬
C.pH��0.68ʱ��������I2��AsO43��
D.pH=5ʱ�������缫��ӦʽΪ2I����2e��=I2
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com