
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.2.0gH218O与D2O的混合物中所含中子数为NA
B.常温常压下,4.4g乙醛所含σ键数目为0.7 NA
C.标准状况下,5.6L CO2与足量Na2O2反应转移的电子数为0.5 NA
D.50ml 12mol/L盐酸与足量MnO2共热,转移的电子数为0.3 NA
【答案】A
【解析】解:A.2.0gH218O与D2O的物质的量为: ![]() =0.1mol,二者分子中都含有10个中子,则0.1mol混合物中含有1mol中子,所含中子数为NA , 故A正确;
=0.1mol,二者分子中都含有10个中子,则0.1mol混合物中含有1mol中子,所含中子数为NA , 故A正确;
B.4.4g乙醛的物质的量为: ![]() =0.1mol,0.1mol乙醛分子中含有σ键的物质的量为:0.1mol×6=0.6mol,其数目为0.6NA , 故B错误;
=0.1mol,0.1mol乙醛分子中含有σ键的物质的量为:0.1mol×6=0.6mol,其数目为0.6NA , 故B错误;
C.标准状况下5.6L二氧化碳的物质的量为: ![]() =0.25mol,0.25mol二氧化碳与足量过氧化钠反应生成0.125mol氧气,转移电子的物质的量为:0.125mol×2=0.25mol,转移的电子数为0.25NA , 故C错误;
=0.25mol,0.25mol二氧化碳与足量过氧化钠反应生成0.125mol氧气,转移电子的物质的量为:0.125mol×2=0.25mol,转移的电子数为0.25NA , 故C错误;
D.二氧化锰只能与浓盐酸反应,当浓盐酸变成稀盐酸时反应停止,4molHCl反应时转移2mol电子,50mL12mol/L盐酸的物质的量为:n(HCl)=cV=12mol/L×0.05L=0.6mol,0.6mol盐酸不能完全反应,则转移的电子的物质的量小于0.3mol电子,即小于0.3NA个,故D错误;
故选A.


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:
【题目】有机物A可发生如图转化(方框内物质均为有机物,部分无机产物已略去): 
已知: ![]() (R、R′可表示烃基或官能团)
(R、R′可表示烃基或官能团)
请回答:
(1)F蒸气密度是相同条件下H2密度的31倍,且分子中无甲基.已知1mol F与足量钠作用产生H2 22.4L(标准状况),则F的分子式是;
(2)G与F的相对分子质量之差为4,则G的性质是(填字母);
a.可与银氨溶液反应 b.可与乙酸发生酯化反应
c.可与氢气发生加成反应 d.1mol G可与2mol新制Cu(OH)2发生反应
(3)D能与NaHCO3反应,且两分子D可以反应得到含有六元环的酯类化合物,E可使溴的四氯化碳溶液褪色,则D→E的化学方程式是;
(4)B的同分异构体较多,写出一种不含甲基能发生银镜反应的同分异构体结构简式:;
(5)A转化为B和F的化学方程式是;
(6)某烃分子H的碳原子数小于10,核磁共振氢谱只有一组峰,在相同条件下也可发生类似B→C的反应并只生成一种有机物I,I的结构简式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验是化学研究的基础.下列关于各实验装置的叙述正确的是( ) 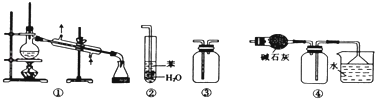
A.装置③可用于收集H2、CO2、Cl2、NH3等气体
B.装置②可用于吸收NH3或HCl气体,并防止倒吸
C.装置①常用于分离互不相溶的液体混合物
D.装置④可用于干燥、收集氯化氢,并吸收多余的氯化氢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为减少汽车对城市大气的污染,我国成功地开发出以新燃料作能源的“绿色汽车”,这种汽车可避免有毒的有机铅、芳香烃等有害物质的排放,保护环境。这种“绿色汽车”的燃料是 ( )
A.甲醇
B.汽油
C.柴油
D.重油
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期表的说法正确的是
A. 每一周期的元素都从碱金属开始,最后以稀有气体结束
B. 某元素原子最外层电子数为2,则该元素一定位于ⅡA
C. 第二、三周期上下相邻的元素的原子核外电子数相差8个
D. 元素周期表有七个横行即7个周期,十六个纵行即十六个族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对于过氧化钠的叙述中,正确的是( )
A.将少量Na2O2投入紫色石蕊试液中,溶液最终呈蓝色
B.1 mol Na2O2与CO2和水蒸气的混合气体完全反应,转移1 mol电子
C.充分加热等物质的量的Na2O2和NaHCO3的混合物,剩余物质为Na2CO3
D.a g CO和CH4的混合气体充分燃烧的产物与足量的Na2O2充分反应后,固体质量增加a g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】法国化学家V.Grignard,所发明的Grignard试剂(卤代烃基镁)广泛运用于有机合成.Grignard试剂的合成方法是:RX+Mg ![]() RMgX(Grignard试剂).生成的卤代烃基镁与具有羰基结构的化合物(醛、酮等)发生反应,再水解就能合成各种指定结构的醇:
RMgX(Grignard试剂).生成的卤代烃基镁与具有羰基结构的化合物(醛、酮等)发生反应,再水解就能合成各种指定结构的醇: 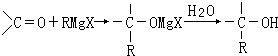
现以2﹣丁烯和必要的无机物为原料合成3,4﹣二甲基﹣3﹣己醇,进而合成一种分子式为C10H16O4的具有六元环的物质J,合成线路如下,H的一氯代物只有3种.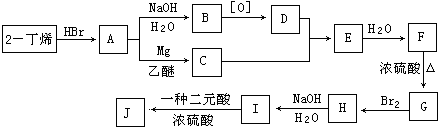
请按要求填空:
(1)D中官能团的名称为;F的结构简式是 .
(2)C+D→E的反应类型是 , F→G的反应类型是;
(3)写出下列化学反应方程式(有机物请用结构简式表示):
A→B ,
I→J ,
(4)化合物G在一定条件下发生加聚反应的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯是一种化工原料和溶剂,在科研和生产中应用广泛.请回答下列问题.
(1)苯易挥发且有 , 所以苯在油漆中用作溶剂不符合绿色化学的基本原则.
(2)往盛有3mL溴水的试管中加入2mL苯,充分振荡、静置分层后,颜色较深的是(填“上”或“下”)层.
(3)苯分子中6个碳原子连接成平面正六边形结构,6个碳原子间的共价键完全相同.由此推测,苯分子中任意相邻2个碳原子间平均共用的电子个数是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是(填序号),本实验所需玻璃仪器E规格为mL.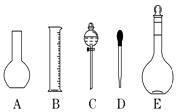
(2)下列操作中,容量瓶所不具备的功能有(填序号).
A.配制一定体积准确浓度的标准溶液
B.长期贮存溶液
C.用来加热溶解固体溶
D.量取一定体积的液体
(3)在配制NaOH溶液实验中,其他操作均正确.若定容时仰视刻度线,则所配制溶液浓度0.1mol/L (填“大于”“等于”或“小于”,下同).若NaOH溶液未冷却即转移至容量瓶定容,则所配制溶液浓度0.1mol/L.
(4)根据计算得知,所需质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为 mL(计算结果保留一位小数).如果实验室有10mL、25mL、50mL量筒,应选用 mL规格的量筒最好.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com