
【题目】实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是(填序号),本实验所需玻璃仪器E规格为mL.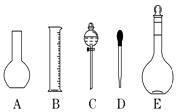
(2)下列操作中,容量瓶所不具备的功能有(填序号).
A.配制一定体积准确浓度的标准溶液
B.长期贮存溶液
C.用来加热溶解固体溶
D.量取一定体积的液体
(3)在配制NaOH溶液实验中,其他操作均正确.若定容时仰视刻度线,则所配制溶液浓度0.1mol/L (填“大于”“等于”或“小于”,下同).若NaOH溶液未冷却即转移至容量瓶定容,则所配制溶液浓度0.1mol/L.
(4)根据计算得知,所需质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为 mL(计算结果保留一位小数).如果实验室有10mL、25mL、50mL量筒,应选用 mL规格的量筒最好.
【答案】
(1)AC,500
(2)B,C,D
(3)小于,大于
(4)13.6,25
【解析】解:(1)配制一定物质的量浓度的溶液的步骤为:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀等,使用的仪器为:托盘天平(或量筒)、烧杯、玻璃棒、胶头滴管、容量瓶;不需要的是平底烧瓶和分液漏斗;配制0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液450mL,实验室没有450mL容量瓶,应选择500mL规格容量瓶;
所以答案是:AC;500;
(2)容量瓶只能用来配制一定体积准确浓度的溶液,不能配制或测量容量瓶规格以下的任意体积的液体,不能稀释或溶解药品,不能用来加热溶解固体溶质,
故选:BCD;
(3)在配制NaOH溶液实验中,其他操作均正确.若定容时仰视刻度线,导致溶液体积偏大,则所配制溶液浓度小于0.1mol/L;
若NaOH溶液未冷却即转移至容量瓶定容,冷却后,液面下降,溶液体积偏小,则所配制溶液浓度大于0.1mol/L;
所以答案是:小于;大于;
(4)质量分数为98%、密度为1.84g/cm3的浓硫酸的物质的量浓度为c(浓硫酸)= ![]() =
= ![]() =18.4mol/L,浓硫酸稀释前后溶质的物质的量不变,设浓硫酸的体积为V,所以18.4mol/L×V=0.5/L×0.5L,得V=0.0136L=13.6mL,选取的量筒规格应该等于或大于量取溶液体积,故选25mL量筒;
=18.4mol/L,浓硫酸稀释前后溶质的物质的量不变,设浓硫酸的体积为V,所以18.4mol/L×V=0.5/L×0.5L,得V=0.0136L=13.6mL,选取的量筒规格应该等于或大于量取溶液体积,故选25mL量筒;
所以答案是:13.6;25.
【考点精析】掌握配制一定物质的量浓度的溶液是解答本题的根本,需要知道配制物质的量浓度溶液时,先用烧杯加蒸馏水至容量瓶刻度线1cm~2cm后,再改用交投滴管加水至刻度线.


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.2.0gH218O与D2O的混合物中所含中子数为NA
B.常温常压下,4.4g乙醛所含σ键数目为0.7 NA
C.标准状况下,5.6L CO2与足量Na2O2反应转移的电子数为0.5 NA
D.50ml 12mol/L盐酸与足量MnO2共热,转移的电子数为0.3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是元素周期表的一部分,表中的每个字母表示一种短周期元素,请回答下列问题: 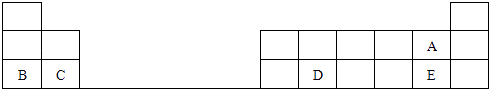
(1)写出D的原子结构示意图 .
(2)A、E两种元素所形成的气态氢化物,稳定性HAHE(填“>”、“<”).
(3)B、C两元素的原子半径,BC(填“>”、“<”).
(4)在盛有水的小烧杯中加入B的单质,写出该反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列有关图象,说法正确的是( ) 
A.由图Ⅰ知,反应在T1、T3处达到平衡,且该反应的△H<0
B.由图Ⅱ知,反应在t6时,NH3体积分数最大
C.由图Ⅱ知,t3时采取降低反应温度的措施
D.Ⅲ在10L容器、850℃时反应,由图知,到4min时,反应放出51.6kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】党的十九届四中全会明确指出“促进人与自然和谐共生”。下列有关做法不正确的是
A.将废旧电池集中深埋,防止重金属污染B.提高车用燃油、燃气品质,减少大气污染
C.推广使用高效、低毒农药,减轻水体污染D.使用可降解聚二氧化碳塑料,减少白色污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.沸点:正戊烷>2﹣甲基丁烷>丙烷
B.将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色
C.相对分子质量相近的醇比烷烃沸点高是因为醇分子间存在氢键
D. 的名称为2,2,4﹣三甲基﹣4﹣戊烯
的名称为2,2,4﹣三甲基﹣4﹣戊烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组依据反应AsO43﹣+2H++2I﹣AsO33﹣+I2+H2O设计如图1原电池,探究pH对AsO43﹣氧化性的影响.测得电压与pH的关系如图2.下列有关叙述错误的是( ) 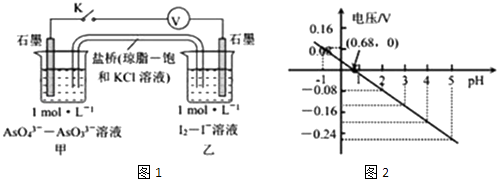
A.pH>0.68时,甲烧杯中石墨为负极
B.pH=0.68时,反应处于平衡状态
C.pH<0.68时,氧化性I2<AsO43﹣
D.pH=5时,负极电极反应式为2I﹣﹣2e﹣=I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室现有3种酸碱指示剂,其pH的变色范围如下:甲基橙:3.1~4.4石蕊:50~8.0酚酞:8.2~10.0用0.1000mol·L-1NaOH溶液滴定未知浓度的CH3COOH溶液,反应恰好完全时,下列叙述正确的是( )
A. 溶液呈中性,可选用甲基橙或酚酞作指示剂
B. 溶液呈中性,只能选用石蕊作指示剂
C. 溶液呈碱性,可选用甲基橙或酚酞作指示剂
D. 溶液呈碱性,只能选用酚酞作指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是周期表中前四周期的元素,其有关性质或结构信息如下表:
元素 | 有关性质或结构信息 |
A | 负二价的A元素的氢化物在通常状况下是一种液体,其中A的质量分数为88.9% |
B | B原子得到一个电子后3p轨道全充满 |
C | C原子的p轨道半充满,它的气态氢化物能与其最高价氧化物的水化物反应生成一种常见的盐X |
D | D元素的最高化合价与最低化合价的代数和为零,其最高价氧化物为分子晶体 |
E | E的单质是日常生活中用量最大的金属材料 |
(1)元素Y是C下一周期同主族元素,比较B、Y元素第一电离能的大小I1(B)I1(Y).(填“>”或“=”或“<”)
(2)E元素原子的核外电子排布式为 .
(3)B元素最高价含氧酸一定比D元素最高价含氧酸的酸性(填“强”或“弱”).
(4)C单质分子中σ键和π键的个数比为 , C的氢化物在同族元素的氢化物中沸点出现反常,其原因是 .
(5)用高能射线照射液态H2A时,一个H2A分子能释放出一个电子,同时产生一种具有较强氧化性的阳离子,试写出该阳离子的电子式: . 写出该阳离子与硫的氢化物的水溶液反应出现黄色浑浊的离子方程式: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com