
【题目】根据下列有关图象,说法正确的是( ) 
A.由图Ⅰ知,反应在T1、T3处达到平衡,且该反应的△H<0
B.由图Ⅱ知,反应在t6时,NH3体积分数最大
C.由图Ⅱ知,t3时采取降低反应温度的措施
D.Ⅲ在10L容器、850℃时反应,由图知,到4min时,反应放出51.6kJ的热量
【答案】D
【解析】解:A、由图Ⅰ知,反应在T1、T3处反应物和生成物的体积分数相对但反应不一定达到平衡,T2﹣T3升高温度,反应物体积分数增大,生成物体积分数减小,平衡向逆反应方向移动,所以正反应是放热反应,△H<0,故A错误; B、由图Ⅱ知,t2时刻正逆反应速率都增大且相等,改变的条件是加入催化剂,平衡不移动;t3时刻正逆反应速率都减小,且逆反应速率大于正反应速率,改变的条件是减小压强,平衡向逆反应方向移动;t5时刻正逆反应速率都增大,且逆反应速率大于正反应速率,改变的条件是升高温度,平衡向逆反应方向移动,所以反应在t1时,NH3体积分数最大,故B错误;
C、由图Ⅱ知,t3时刻正逆反应速率都减小,且逆反应速率大于正反应速率,改变的条件是减小压强,故C错误;
D、该反应是一个放热反应,1molCO完全转化时放出43KJ能量,当转化(0.30﹣0.18)mol/L×10L=1.2molCO时放出51.6kJ的热量,故D正确;
故选D.
A、反应物和生成物的体积分数相同时,反应不一定达到平衡状态,升高温度平衡向吸热反应方向移动;
B、t1时刻正逆反应速率相等,反应达到平衡状态;t2时刻正逆反应速率都增大且相等,改变的条件是加入催化剂;t3时刻正逆反应速率都减小,且逆反应速率大于正反应速率,改变的条件是减小压强;t5时刻正逆反应速率都增大,且逆反应速率大于正反应速率,改变的条件是升高温度;
C、降低温度平衡向吸热反应方向移动;
D、根据反应热与反应物物质的量之间的关系式计算.


科目:高中化学 来源: 题型:
【题目】为减少汽车对城市大气的污染,我国成功地开发出以新燃料作能源的“绿色汽车”,这种汽车可避免有毒的有机铅、芳香烃等有害物质的排放,保护环境。这种“绿色汽车”的燃料是 ( )
A.甲醇
B.汽油
C.柴油
D.重油
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯是一种化工原料和溶剂,在科研和生产中应用广泛.请回答下列问题.
(1)苯易挥发且有 , 所以苯在油漆中用作溶剂不符合绿色化学的基本原则.
(2)往盛有3mL溴水的试管中加入2mL苯,充分振荡、静置分层后,颜色较深的是(填“上”或“下”)层.
(3)苯分子中6个碳原子连接成平面正六边形结构,6个碳原子间的共价键完全相同.由此推测,苯分子中任意相邻2个碳原子间平均共用的电子个数是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一化学平衡状态体系中,发生下列量的变化,其中一定会使平衡发生移动的是()
A. 体系的压强 B. 反应物的浓度
C. 正、逆反应速率 D. 反应物的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对金属制品进行腐蚀处理,可延长其使用寿命,以下为铝材表面处理的一种方法: 
(1)碱洗的目的是除去铝材表面的自然氧化膜,碱洗(如用NaOH)时除氧化膜转变为AlO2﹣外,常有少量气体冒出,该气体是(填“CO2”、“O2”或“H2”)
(2)为将碱洗后槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的(填“NH3H2O”、“CO2”或“H2SO4”)
(3)以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极的电极反应式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在入住装修过的新房之前,下列做法中正确的是 ( )
A.紧闭门窗,防止装修面干裂、变质
B.适度开窗通气,充分地进行内外空气对流
C.用高浓度的甲醛溶液对室内环境消毒
D.在各个房间内喷洒空气清新剂,以免有异味
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是(填序号),本实验所需玻璃仪器E规格为mL.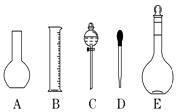
(2)下列操作中,容量瓶所不具备的功能有(填序号).
A.配制一定体积准确浓度的标准溶液
B.长期贮存溶液
C.用来加热溶解固体溶
D.量取一定体积的液体
(3)在配制NaOH溶液实验中,其他操作均正确.若定容时仰视刻度线,则所配制溶液浓度0.1mol/L (填“大于”“等于”或“小于”,下同).若NaOH溶液未冷却即转移至容量瓶定容,则所配制溶液浓度0.1mol/L.
(4)根据计算得知,所需质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为 mL(计算结果保留一位小数).如果实验室有10mL、25mL、50mL量筒,应选用 mL规格的量筒最好.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X,含有Fe3+、Fe2+、Ba2+、Al3+、NH4+、CO32﹣、SiO32﹣、SO42﹣、NO3﹣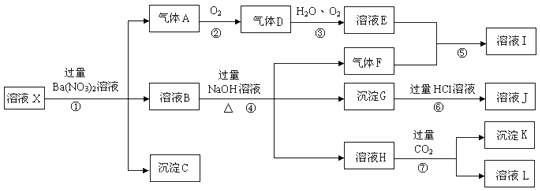
依据以上信息,回答下列问题:
(1)写出步骤①生成气体A的离子方程式 .
(2)气体F的电子式为 , 实验中,可以观察到反应②的现象是: .
(3)检验溶液I中存在的阳离子的方法是 .
(4)沉淀G的化学式为;写出反应⑦的化学方程式 .
(5)溶液X中肯定存在的离子有 , 可能存在的离子有 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列几种离子晶体,说法不正确的是( )
A.由于NaCl 晶体和CsCl晶体中正负离子半径比( ![]() )不相等,所以两晶体中离子的配位数不相等
)不相等,所以两晶体中离子的配位数不相等
B.CaF2晶体中,Ca2+配位数为8,F﹣配位数为4不相等,主要是由于F﹣、Ca2+电荷(绝对值)不相同
C.MgO的熔点比MgCl2高主要是因为MgO的晶体能比MgCl2大
D.MCO3中M2+半径越大,MCO3热分解温度越低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com