
����Ŀ���Խ�����Ʒ���и�ʴ���������ӳ���ʹ������������Ϊ���ı��洦����һ�ַ����� 
��1����ϴ��Ŀ���dz�ȥ���ı������Ȼ����Ĥ����ϴ������NaOH��ʱ������Ĥת��ΪAlO2���⣬������������ð���������������CO2������O2����H2����
��2��Ϊ����ϴ���Һ�е����Գ�����ʽ���գ�������Һ�м��������Լ��е����NH3H2O������CO2����H2SO4����
��3��������Ϊ��������H2SO4��Һ�е�⣬���ı����γ�����Ĥ�������ĵ缫��ӦʽΪ ��
���𰸡�
��1��H2
��2��CO2
��3��2Al+3H2O��6e��=Al2O3+6H+
���������⣺�����̿�֪����ϴ��Ŀ���dz�ȥ���ı������Ȼ����Ĥ���۲쵽���ݣ�����2Al+2NaOH+2H2O=2NaAlO2+3H2����Ȼ���ϴ��Һ����AlO2�� �� ��Ӧͨ��CO2������Al��OH��3 �� ������Ӧ2AlO2��+3H2O+CO2�T2Al��OH��3��+CO32����CO2+2H2O+AlO2���THCO3��+Al��OH��3�����������ǿ����ɵij�����������ܽ⣬�ϵ��Һ�к������ӣ���̼�����Ʒ�Ӧ���ɶ�����̼������ϴ��������ھ�ˮϴ�����ң�����Ϊ�������������ҺΪϡ���ᣬ���������ı����γ�����Ĥ���ɵõ���ʴ���ġ�
��1.����ϴ��Ŀ���dz�ȥ���ı������Ȼ����Ĥ����ϴʱ��������ð����ԭ����2Al+2OH��+2H2O=2AlO2��+3H2������������Ϊ���������Դ��ǣ�H2��
��2.����ϴ��Һ����AlO2�� �� ��Ӧͨ��CO2������Al��OH��3 �� ������Ӧ2AlO2��+3H2O+CO2�T2Al��OH��3��+CO32����CO2+2H2O+AlO2���THCO3��+Al��OH��3�������Դ��ǣ�CO2��
��3.����������ʧ���Ӻ�ˮ��Ӧ�����������������ӣ��缫��ӦʽΪ2Al+3H2O��6e��=Al2O3+6H+�����Դ��ǣ�2Al+3H2O��6e��=Al2O3+6H+ ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D�����ֳ����ĵ��ʣ�A��BΪ������C��D�����������壬��DΪ����ɫ���壮�ס��ҡ���Ϊ�����Ļ���������ʾ��д��ԣ�����֮������ͼ��ת����ϵ�� 
��ش��������⣺
��1��B���Ӧ�Ļ�ѧ����ʽ�� �� B��NaOH��Һ��Ӧ�����ӷ���ʽ�� �� ��������������Һ��Ӧ�����ӷ���ʽ�� ��
��2������B�������ӵ���Һ������Һ��Ӧ�õ�һ�ְ�ɫ�������÷�Ӧ�����ӷ���ʽ�� ��
��3��ʵ���Ҽ������Һ���������������ӵIJ��������������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڱ�ǰ�����ڵ�Ԫ��A��B��C��D��E��ԭ��������������A�ĺ����������������������ͬ��B�ļ۵��Ӳ���δ�ɶԵ�����3����C������������Ϊ���ڲ��������3����D��Cͬ�壻E�������ֻ��1�����ӣ����������18�����ӣ��ش��������⣻
��1��B��C��D�е�һ����������������Ԫ�ط��ţ���C�ĵ����Ų�ʽΪ ��
��2��A������Ԫ���γɵĶ�Ԫ���ۻ������У����ӳ������Σ��÷��ӵ�����ԭ�ӵ��ӻ���ʽΪ�������мȺ��м��Թ��ۼ����ֺ��зǼ��Թ��ۼ��Ļ����������ѧʽ����
��3����ЩԪ���γɵĺ������У����ӵ�����ԭ�ӵļ۲���Ӷ���Ϊ3������������������ṹ������ �� ���ѧʽ��
��4��E��C�γɵ�һ�����ӻ�����ľ���ṹ��ͼ��a������E�����ӷ���Ϊ �� 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��Ԫ�����ڱ���һ���֣����е�ÿ����ĸ��ʾһ�ֶ�����Ԫ�أ���ش��������⣺ 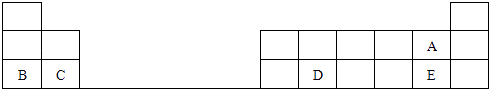
��1��д��D��ԭ�ӽṹʾ��ͼ ��
��2��A��E����Ԫ�����γɵ���̬�⻯��ȶ���HAHE�������������������
��3��B��C��Ԫ�ص�ԭ�Ӱ뾶��BC�������������������
��4����ʢ��ˮ��С�ձ��м���B�ĵ��ʣ�д���÷�Ӧ�Ļ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���У���������
A. ϡ������Ԫ��ԭ�ӵ�������������Ϊ8��
B. Ԫ�����ڱ�����7�����塢7������
C. ̼Ԫ��λ�ڵ�2����IVA��
D. ������еĻ�ѧ���ǹ��ۼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������й�ͼ��˵����ȷ���ǣ� �� 
A.��ͼ��֪����Ӧ��T1��T3���ﵽƽ�⣬�Ҹ÷�Ӧ�ġ�H��0
B.��ͼ��֪����Ӧ��t6ʱ��NH3����������
C.��ͼ��֪��t3ʱ��ȡ���ͷ�Ӧ�¶ȵĴ�ʩ
D.����10L������850��ʱ��Ӧ����ͼ֪����4minʱ����Ӧ�ų�51.6kJ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʮ�Ž�����ȫ����ȷָ�����ٽ�������Ȼ��г�������������й���������ȷ����
A.���Ͼɵ�ؼ�������ֹ�ؽ�����ȾB.��߳���ȼ�͡�ȼ��Ʒ�ʣ����ٴ�����Ⱦ
C.�ƹ�ʹ�ø�Ч���Ͷ�ũҩ������ˮ����ȾD.ʹ�ÿɽ���۶�����̼���ϣ����ٰ�ɫ��Ⱦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С�����ݷ�ӦAsO43��+2H++2I��AsO33��+I2+H2O�����ͼ1ԭ��أ�̽��pH��AsO43�������Ե�Ӱ�죮��õ�ѹ��pH�Ĺ�ϵ��ͼ2�������й�����������ǣ� �� 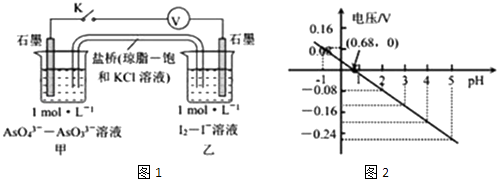
A.pH��0.68ʱ�����ձ���ʯīΪ����
B.pH=0.68ʱ����Ӧ����ƽ��״̬
C.pH��0.68ʱ��������I2��AsO43��
D.pH=5ʱ�������缫��ӦʽΪ2I����2e��=I2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ����٤��������ֵ������������ȷ���ǣ�������
A.���³�ѹ�£�11.2L����������������ԭ��������NA
B.0.5molH2O�����ĵ�����Ϊ9NA
C.8.0gCu2S��CuO�Ļ�����к���ͭԭ����Ϊ0.1NA
D.300mL2molL��1������Һ������������Ϊ0.6NA
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com