
【题目】分别按下图 A、B、C 所示装置进行实验,三个烧杯里的溶液为同浓度的稀硫酸。回答下列问题:
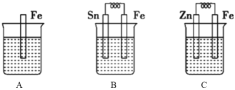
(1)下列叙述中,不正确的是___________。
A.B 中铁片是负极,C 中铁片是正极 B.三个烧杯中铁片表面均无气泡产生 C.产生气泡的速率 A 中比B中慢 D.C 溶液中![]() 向Zn片电极移动
向Zn片电极移动
(2)装置 B中能量转化的主要形式是________________;
(3)装置 B中正极反应式为__________________;
(4)装置 C负极反应式为________________________;
(5)装置 A 中发生反应的离子方程式________________;
(6)Ba(OH)2·8H2O 晶体与 NH4C1晶体的反应属于_______反应(填“吸热”或“放热”)若把此反应设计成原电池,你认为是否可行?_______ (填“是”或“否”)。
【答案】B 化学能转化为电能 2H++2e-=H2↑ Zn—2e-=Zn2+ 2H++Fe=H2↑+Fe2+ 吸热 否
【解析】
形成原电池的条件为:①自发进行的氧化还原反应,②形成闭合回路,故A不是原电池,B、C为原电池;根据原电池正负极判断方式:一般活泼金属做负极,故B中负极铁发生氧化反应,C中铁做正极,发生还原反应,据此解答。
(1) A.根据金属活动性:Zn>Fe>Sn, 一般活泼的金属失电子作负极,因此B中铁片是负极,C中铁片是正极,故A正确;
B.A烧杯中铁直接反应,表面有气泡,C中铁作正极,烧杯中铁表面有气泡,故B错误;
C.B形成原电池,比A中反应速率快,产生气泡的速率A比B中慢,故C正确;
D.原电池中阴离子向负极移动,B中铁片为负极,因此B溶液中![]() 向铁片电极移动,故D
向铁片电极移动,故D
正确;故答案为:B;
(2).装置B形成原电池,变化过程中能量转化的主要形式是:化学能转化为电能;
(3).Sn作正极,正极上氢离子得电子生成氢气,装置B中正极反应式为::2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
(4).活泼金属Zn作负极,负极反应式为: Zn—2e-=Zn2+,故答案为:Zn—2e-=Zn2+;
(5).A中时铁直接与硫酸发生置换反应,故答案为:2H++Fe=H2↑+Fe2+;
(6).常温下,自发进行的氧化还原反应且为放热反应可设计成原电池,Ba(OH)2·8H2O 晶体与 NH4C1晶体的反应为吸热反应,且为非氧化还原反应,不能设计成原电池,故答案为:吸热;否。


科目:高中化学 来源: 题型:
【题目】硫和氮的氧化物直接排放会引发严重的环境问题,请回答下列问题:
Ⅰ.SO2的排放主要来自于煤的燃烧。常用石灰石脱硫,其产物可以做建筑材料。
已知:CaCO3(s)=CO2(g)+CaO(s) ΔH=+178.2kJ/mol
SO2(g)+CaO(s)=CaSO3(s) ΔH=-402kJ/mol
2CaSO3(s)+O2(g)=2CaSO4(s) ΔH=-234.2kJ/mol
写出石灰石脱硫的热化学反应方程式___________________________。
Ⅱ.在一定温度下的恒容容器中,反应2N2O(g)=2N2(g)+O2(g)的部分实验数据如下:
反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
c(N2O) /mol·L-1 | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
①在0~20min 时段,反应速率υ(N2O)为_____。
②若N2O起始浓度c0为0.150mol·L-1,则反应至30min时N2O的转化率α=____,比较不同起始浓度时N2O的分解速率:υ(c0=0.150mol·L-1)____υ(c0=0.100 mol·L-1)(填“>、=或<”)
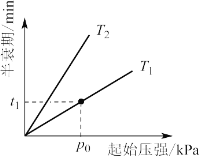
③不同温度(T)下,N2O分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O耗一半时所需的相应时间),则T1__T2(填“>、=或<”)。当温度为T1、起始压强为p0,反应至t1min时,体系压强p=__(用 p0表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如下图所示装置探究碳酸和苯酚的酸性强弱,下列叙述不正确的是(部分夹持仪器省略)
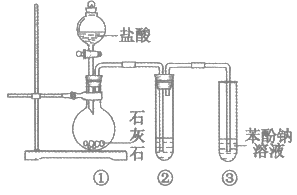
A. 打开分液漏斗旋塞,①中产生无色气泡,③中出现白色浑浊
B. ②中试剂为饱和NaHCO3溶液
C. ③中发生反应的化学方程式是![]()
D. 苯酚有弱酸性,是由于苯基影响了与其相连的羟基的活性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是A、B、C、D四种常见有机物的相关信息。根据表中信息回答下列问题:
有机物A | 有机物B | 有机物C | 有机物D |
①可用于果实催熟 ②比例模型为
| ①由C、H两种元素组成②球棍模型为
| ①生活中常见的液态有机物,分子中碳原子数与有机物A相同 ②能与Na反应,但不能与NaOH反应 | ①相对分子质量比有机物C大14 ②能由有机物C氧化生成 |
(1)有机物B的分子式为___。
(2)下列有关有机物A、B的说法正确的是___。
a.A、B均可使酸性KMnO4溶液褪色
b.A、B分子中所有的原子在同一平面内
c.等质量的A、B完全燃烧,消耗氧气的量相同
d.A、B分子均含有官能团碳碳双键,能发生加成反应
(3)写出有机物C的同分异构体的结构简式___。
(4)在一定条件下,有机物C与有机物D反应能生成具有水果香味的物质E,其化学反应方程式为___;某次实验中以6.0gD为原料制得4.84gE,则反应E的产率为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据图中氮元素及其化合物的转化关系,回答问题:
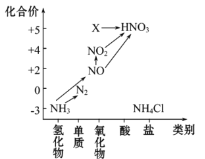
(1)上图中 X 的化学式为______,从化合价上看,X 具有_______性(填“氧化”或“还原”);
(2)写出 NO2 与水反应的化学方程式____________;
(3)写出稀硝酸与铜反应的离子方程式____________;
(4)实验室常用 NH4Cl与 Ca(OH)2 制取氨气,写出反应的化学方程式_________;
(5)下列试剂不能用于干燥 NH3 的是________ (填字母);
A.浓硫酸 B.碱石灰 C.NaOH 固体
(6)氨气是重要的化工原料,写出其催化氧化的化学方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
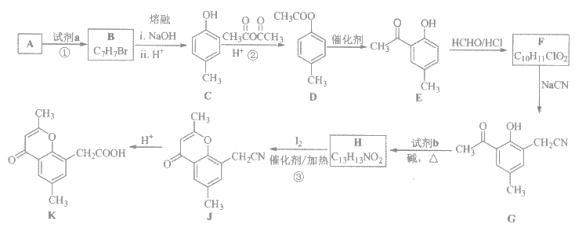
【题目】具有抗菌、消炎作用的黄酮醋酸类化合物L的合成路线如下图所示;
已知部分有机化合物转化的反应式如下:
i、![]() R-CN
R-CN![]() R-COOH(R为烃基)
R-COOH(R为烃基)
ii、![]()
![]()
![]() (R、
(R、![]() 代表烃基或氢)
代表烃基或氢)
iii、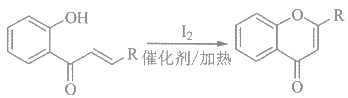 (R、
(R、![]() 代表烃基或氢)
代表烃基或氢)
(1)A的分子式是C7H8,其结构简式是_________;A→B所属的反应类型为_________。
(2)C→D的化学方程式是________________。
(3)写出满足下列条件的D的任意一种同分异构体的结构简式:________。
a 能发生银镜反应 b 与浓溴水反应生成沉淀
c 苯环上有两个取代基,且苯环上的一氯代物有两种
(4)F的结构简式是_________;试剂b是__________________。
(5)H与I2反应生成J和HI的化学方程式是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】老鼠能在多氟碳化物溶液内部潜水游动,科学家预测多氟碳化物可能成为血液替代品。全氟丙烷(C3F8)是一种常见的多氟碳化物,下列对该物质的叙述中不正确的是( )
A. 原子半径C比F的大
B. 全氟丙烷的电子式为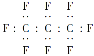
C. 全氟丙烷分子中只含σ键
D. 全氟丙烷分子中既含极性键又含非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知三角锥形分子E和直线形分子G反应,生成两种直线形分子L和M(组成E、G、L、M分子的元素原子序数均小于10),如右图:
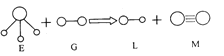
下列判断错误的是
A.G是最活泼的非金属单质B.L能使紫色石蕊试液变红色
C.E能使紫色石蕊试液变蓝色D.M是化学性质很活泼的单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是![]()
![]()
A.NH3易液化,氨常用作制冷剂
B.常温下,可以用铁、铝制容器盛装浓硫酸或浓硝酸
C.铵盐受热易分解,因此贮存铵态氮肥时要密封保存,并放在阴凉通风处
D.与金属反应时,稀HNO3可能被还原为更低价态,则稀HNO3氧化性强于浓HNO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com