
【题目】(1)等物质的量的钠、镁、铝分别与足量盐酸反应,产生的氢气在相同条件下的体积比为______________。
(2)等质量的钠、镁、铝分别与足量盐酸反应,产生的氢气在相同条件下的体积比为________________。
(3)分别将0.2mol的钠、镁、铝分别投入100ml 1mol·L-1的盐酸溶液中,三者产生的氢气在相同条件下的体积比为____________________。
【答案】 1:2:3 1/23:1/12:1/9 =36:69:92 2:1:1
【解析】(1)金属完全反应,令金属的物质的量为1mol,根据电子转移守恒,Na生成氢气的物质的量=![]() =0.5mol,Mg生成氢气为
=0.5mol,Mg生成氢气为![]() =1mol,Al生成氢气为
=1mol,Al生成氢气为![]() =1.5mol,相同条件下,气体体积之比等于其物质的量之比,则Na、Mg、Al生成氢气体积之比=0.5mol:1mol:1.5mol=1︰2︰3;
=1.5mol,相同条件下,气体体积之比等于其物质的量之比,则Na、Mg、Al生成氢气体积之比=0.5mol:1mol:1.5mol=1︰2︰3;
(2)金属完全反应,令质量为1g,则:
2Na~H2↑
46 2
1g![]() =
=![]() g
g
Mg~H2↑
24 2
1g ![]() =
=![]() g
g
2Al~3H2↑
54 6
1g![]() =
=![]() g
g
故Na、Mg、Al生成氢气的质量之比=![]() g︰
g︰![]() g︰
g︰![]() g =36︰69︰92;
g =36︰69︰92;
(3)100mL1mol/L的盐酸的物质的量为0.1L×1mol/L=0.1mol,若将0.2mol金属钠、镁、铝分别投入到100mL1mol/L的盐酸中,可知三种金属都过量,盐酸不足,完全反应,但金属钠能与水反应继续生成氢气,所以镁、铝反应生成氢气一样多,生成的氢气为![]() mol,而钠反应生成氢气最多,其生成氢气为
mol,而钠反应生成氢气最多,其生成氢气为![]() =0.1mol,三者生成氢气的体积比为0.1mol:0.05mol:0.05mol=2:1:1。
=0.1mol,三者生成氢气的体积比为0.1mol:0.05mol:0.05mol=2:1:1。


 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
【题目】据报导,目前我国结核病的发病率有抬头的趋势。抑制结核杆菌的药物除雷米封外,PAS—Na(对氨基水杨酸钠)也是其中一种。它与雷米封可同时服用,可以产生协同作用。已知:
①![]() (苯胺、弱碱性、易氧化)
(苯胺、弱碱性、易氧化)
②![]()
下面是PAS—Na的一种合成路线(部分反应的条件未注明):

按要求回答问题:
(写)出下列反应的化学方程式并配平
A→B:_______________________;
B→C7H6BrNO2:______________________;
(2)出下列物质的结构简式:C:____________________
D:______________________;
(3)出反应类型:II_______________,
(4)D→ E (反应III)所需条件_____________;
(5)写出C到D的化学反应方程式:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)锌锰(Zn—MnO2)干电池应用广泛,其电解质溶液是ZnCl2—NH4Cl混合溶液。
①该电池的负极材料是_________。电池工作时,电子流向_____________(填“正极”或“负极”)。
②若ZnCl2—NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是________________________。
(2)铅蓄电池是常用的化学电源,其电极材料分别是Pb和PbO2,电解液为硫酸。该电池总反应式为:Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O。请根据上述情况判断:
2PbSO4+2H2O。请根据上述情况判断:
①该蓄电池放电时,电解质溶液中阴离子移向_____________(填“正极”或“负极”);正极附近溶液的酸性_____________(填“增强”、“减弱”或“不变”)放电时,负极的电极反应式为:_____________________________(用离子方程式表示)。(已知:硫酸铅为不溶于水的白色沉淀,生成时附着在电极上)
②实验室用铅蓄电池作电源电解饱和食盐水制取氯气,今若制得0.050 mol Cl2,这时电池内消耗的H2SO4的物质的量至少是________________。氢氧燃料电池具有启动快、效率高等优点,其能量密度高于铅蓄电池。若电解质为KOH溶液,则氢氧燃料电池的负极反应式为___________________。该电池工作时,外电路每流过2 mol e-,消耗标况下氧气_________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】日常生活中,下列方法或应急措施不科学的是
A. 利用灼烧法区别羊毛织物和棉织物
B. 用食醋浸泡有水垢的水壶以清除其中的水垢
C. 厨房内发生了燃气泄漏先打开排气扇通风再关掉气阀
D. 将一氧化碳中毒者移到通风处抢救
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适反应条件下,它们可按下面框图进行反应。又知E溶液是无色的。
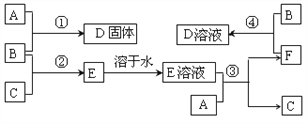
请回答:
(1)A是____________,B是____________,C是_____________。(填化学式)
(2)反应①的化学方程式为________________________________________
(3)反应③的化学方程式为________________________________________
(4)反应④的化学方程式为________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素。M基态原子L层中p 轨道电子数是s轨道电子数的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满。
据此请回答下列问题:
(1)R基态原子的电子排布式是 ,X和Y中电负性较大的是 (填元素符号)。
(2)X的氢化物的沸点低于与其组成相似的M的氢化物,其原因是 。
(3)X与M形成的XM3分子的空间构型是 。
(4)M和R所形成的一种离子化合物R2M晶体的晶胞如右图所示,则图中黑球代表的离子是 (填离子符号)。

(5)在稀硫酸中,Z的最高价含氧酸的钾盐(橙色)氧化M的一种氢化物,Z被还原为+3价,该反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
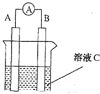
【题目】(1)如图所示,若C为浓硝酸,电流表指针发生偏转,B电极材料为Fe ,A电极材料为Cu,则B电极的电极反应式为______________,A电极的电极反应式为 ;反应进行一段时间后溶液C的pH将 (填“升高”“降低”或“基本不变”)。
(2)我国首创以铝空气海水电池作为能源的新型的海水标志灯,以海水为电解质溶液,靠空气中的氧气使铝不断氧化而产生电流,只要把灯放入海水数分钟,就会发出耀眼的白光。则电源的负极材料是________,负极反应为___________;正极反应为_______________________。
(3)熔盐电池具有高的发电效率,因而受到重视, 可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得在650 ℃下工作的燃料电池,完成有关电池反应式。负极反应式为2CO+2CO32-4e-=4CO2,正极反应式为________________________,电池总反应式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产和生活密切相关,下列有关说法正确的是( )
A. 英文的“中国”一词又指“瓷器”,中国瓷器驰名世界,其主要成分是SiO2
B. 为防止中秋月饼等富脂食品氧化变质,常在包装袋中放人生石灰
C. 二氧化硫有毒,严禁将其添加到任何食品和饮料中
D. 泡沫灭火器中用的是小苏打和硫酸铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C均为芳香族化合物,已知有机物A的结构简式为请回答下列问题:
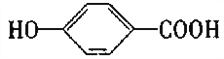
(1)写出A和NaHCO3溶液反应的化学方程式_____________________________________________。
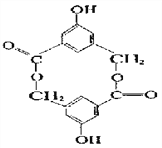
(2)有机物B在浓H2SO4作用下,可生成一种环状酯,如右图。写出B的结构简式____________;等物质的量B与Na、NaOH、NaHCO3充分反应,消耗Na、NaOH、NaHCO3的物质的量之比为___。
(3)C与B互为同分异构体,苯环上一氯取代物只有两种,C不与NaHCO3反应,能与Na、NaOH反应,等质量C消耗Na、NaOH物质的量之比为2∶3,则C可能的结构简式为__________。(写出其中任意一种即可)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com