
【题目】下列五种有色溶液与SO2作用,均能褪色,其实质相同的是( )
①品红溶液 ②KMnO4酸性溶液 ③氯水 ④滴有酚酞的NaOH溶液
A. ②③ B. ①② C. ①④ D. ②④
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
【题目】工业上可用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡常数 | 温度/℃ | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g) | K3 | ||
(1)据反应①与②可推导出K1、K2与K3之间的关系,则K3=________(用K1、K2表示)。500 ℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol·L-1)分别为0.8、0.1、0.3、0.15,则此时v正________v逆(填“>”、“=”或“<”)。
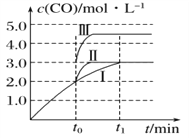
(2)在3 L容积可变的密闭容器中发生反应②,已知c(CO)—反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是_______________。当曲线Ⅰ变为曲线Ⅲ时,改变的条件是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应∶2NO2![]() 2NO+O2在密闭容器中反应,达到平衡状态的标志是( )
2NO+O2在密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n molO2的同时生成2n molNO2;②单位时间内生成n molO2 的同时,生成2n mol NO;③用NO2、NO、O2 的物质的量浓度变化表示的反应速率的比为2 : 2 : 1的状态;④混合气体的颜色不再改变的状态;⑤混合气体的密度不再改变的状态;⑥ 混合气体的平均相对分子质量不再改变的状态
A. ①④⑥ B. ②③⑤ C. ①③④ D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列两种试剂不能做喷泉实验的是( )
A. NO2 水 B. CO2 4 molL-1NaOH溶液
C. Cl2 饱和NaCl溶液 D. NH3 1 molL-1盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组欲测定室温下(25 ℃、101 kPa)的气体摩尔体积,请回答以下问题。该小组设计的简易实验装置如下图所示:

该实验的主要操作步骤如下:
步骤一:
(1)①配制100 mL 1.0 mol·L-1的盐酸,需要20%,密度为1.1g·cm-3的盐酸的体积为______。
②配制过程中所需要的玻璃仪器有__________________________________________。
③下列操作会导致物质的量浓度偏大的是_________________
A.转移溶液后未洗涤烧杯和玻璃棒就直接定容
B.在容量瓶中进行定容时仰视刻度线
C.在容量瓶中进行定容时俯视刻度线
D.定容后把容量瓶倒置摇匀,发现液面低于刻度线,又补足了所缺的水
步骤二: 用量筒量取出10.0 mL 1.0 mol·L-1的盐酸加入锥形瓶中;
步骤三: (2)称取a g已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少为________;
步骤四: 往广口瓶中装入足量水,按上图连接好装置,检查装置的气密性;
步骤五: (3)反应结束后待体系温度恢复至室温,读取量筒中水的体积为V mL。
①实验步骤五中应选用________(填序号)的量筒。
A.100 mL B.200 mL C.500 mL
②读数时除恢复到室温,视线与液体凹液面的最低处相平外,还要注意_____________________。
③若忽略水蒸气的影响,在实验条件下测得气体摩尔体积的计算公式为Vm=________,若未除去镁条表面的氧化膜,则测量结果________(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】10 g 10%的氢氧化钠溶液稀释成50 mL,所得氢氧化钠溶液的物质的量浓度为
A.0.02 mol/L B.0.05 mol/L
C.0.25 mol/L D.0.5 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com