
【题目】工业上可用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡常数 | 温度/℃ | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g) | K3 | ||
(1)据反应①与②可推导出K1、K2与K3之间的关系,则K3=________(用K1、K2表示)。500 ℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol·L-1)分别为0.8、0.1、0.3、0.15,则此时v正________v逆(填“>”、“=”或“<”)。
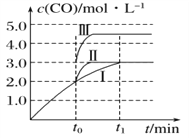
(2)在3 L容积可变的密闭容器中发生反应②,已知c(CO)—反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是_______________。当曲线Ⅰ变为曲线Ⅲ时,改变的条件是______________。
【答案】 K1·K2 > 催化剂 将容器容积迅速压缩至2L
【解析】(1)已知:①2H2(g)+CO(g) ![]() CH3OH(g) K1,②H2(g)+CO2(g)
CH3OH(g) K1,②H2(g)+CO2(g) ![]() H2O(g)+CO(g) K2,根据盖斯定律,①+②得3H2(g)+CO2(g)
H2O(g)+CO(g) K2,根据盖斯定律,①+②得3H2(g)+CO2(g) ![]() CH3OH(g)+H2O(g) K3=K1×K2;在500℃、2L的密闭容器中,进行反应③3H2(g)+CO2(g)
CH3OH(g)+H2O(g) K3=K1×K2;在500℃、2L的密闭容器中,进行反应③3H2(g)+CO2(g) ![]() CH3OH(g)+H2O(g) K3=K1×K2=2.5,在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O (g)的浓度(mol/L)分别为0.8、0.1、0.3、0.15,Q=
CH3OH(g)+H2O(g) K3=K1×K2=2.5,在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O (g)的浓度(mol/L)分别为0.8、0.1、0.3、0.15,Q=![]() =0.87<K=2.5,反应正向进行,V正>V逆,故答案为:K1K2;>;
=0.87<K=2.5,反应正向进行,V正>V逆,故答案为:K1K2;>;
(2)根据图象可知,曲线Ⅰ变化为曲线Ⅱ时缩短了反应达到平衡的时间,最后达到相同平衡状态,在容积可变的密闭容器中,说明改变的条件是加入了催化剂;当曲线Ⅰ变为曲线Ⅲ时CO的浓度增大,CO物质的量增大,反应②是气体体积不变的反应,在可变容器中,气体体积和浓度成反比,气体物质的量不变。曲线Ⅰ对应的体积3L,平衡时一氧化碳浓度为3mol/L,改变条件当曲线Ⅰ变为曲线Ⅲ时,一氧化碳平衡浓度为4.5mol/L,说明体积减小,设体积为V,则3:V=4.5:3,V=2L,所以改变的条件是将容器的体积快速压缩至2L,故答案为:加入催化剂;将容器的体积快速压缩至2L。


科目:高中化学 来源: 题型:
【题目】元素的性质随着原子序数的递增出现周期性变化的根本原因是( )
A.原子核外电子排布呈周期性变化B.化合价呈周期性变化
C.单质熔沸点呈周期性变化D.原子半径从小到大的周期性变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C 分别代表中学化学中的常见物质,请根据题目要求回答下列问题:
(1)实验室常用A的饱和溶液制备微粒直径为1nm-100nm的红褐色液相分散系。则该反应的化学方程式为:_________________________,将A 的溶液加热蒸干并灼烧,得到固体的化学式为:________。
(2)B为地壳中含量最高的金属元素的氯化物,向50.0mL,4mol/L的B溶液中逐滴滴入100mL 某浓度的KOH溶液,若产生7.8g白色沉淀,则加入的KOH溶液的浓度可能为_________________________。
(3)将A、B中两种金属元素的单质用导线连接,插入同一个盛有KOH溶液的烧杯中构成原电池,则负极发生的电极反应为:_____________________________________。
(4)C是常见温室气体,将一定量的气体C通入100mL某浓度的KOH溶液得溶液F,向F溶液中逐滴加入2 mol·L-1的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。
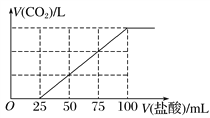
则F 溶质与足量石灰水发生反应最多可得沉淀的质量为_______________g。
(5)pH=3.6时,碳酸钙与硫酸铝反应可制备碱式硫酸铝[Al2(SO4)x(OH)6-2x]溶液。若溶液的pH偏高,则碱式硫酸铝产率降低且有气体C产生,用化学方程式表示其原因: ______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ. 硒化锌是一种透明半导体,也可作为红外光学材料,熔点是1 520 ℃。
(1)基态锌原子的价电子排布式是_______。
(2)根据元素周期律,电负性Se____S,第一电离能Se____As(填“>”或“<”)。
(3)H2Se的分子构型是____,其中硒原子的杂化轨道类型是____。
(4)H2O的沸点高于H2Se的沸点(-42 ℃),其原因是________________。
(5)晶体Zn为六方最密堆积,其配位数是____。
Ⅱ 氮及其化合物与人类生产、生活息息相关。回答下列问题:
(1)C、N、O三种元素第一电离能从大到小的顺序是________。
(2)1 mol N2F2含有____ mol σ键。
(3)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一。1 mol NH4BF4含____ mol配位键。
(4)安全气囊打开时发生的化学反应为10NaN3+2KNO3 = K2O+5Na2O+16N2↑。
①写出与N2互为等电子体的分子________。
②Na2O的晶胞结构如图所示,晶胞边长为566 pm,晶胞中氧原子的配位数为____,Na2O晶体的密度为______(只要求列算式,不必计算出结果),Na+ 与O2-间的最短距离为_____pm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某新产品磨牙器能有效帮助去除牙齿表面的牙垢,磨牙器磨头采用50%橡胶与50%的金刚砂(主要成分为碳化硅)特制而成。已知碳化硅中碳元素显-4价,硅元素显+4价,则碳化硅的化学式为
A. SiC B. Si2C3 C. Si3C2 D. SiC2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在生物体内含量较少,但对维持生物体正常生命活动必不可少的元素是( )
A. Fe、Mn、Zn、Mg B. Zn、Cu、Mn、Ca
C. Zn、Cu、B、Mn D. Mg、Mn、Cu、Mo
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。已知:3I2+6OH-=IO3-+5I-+3H2O,下列说法不正确的是( )

A. 右侧发生的电极方程式:2H++2e-=H2↑
B. 电解结束时,右侧溶液中含有IO3-
C. 电解槽内发生反应的总化学方程式KI+3H2O=KIO3+3H2↑
D. 如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学方程式不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列五种有色溶液与SO2作用,均能褪色,其实质相同的是( )
①品红溶液 ②KMnO4酸性溶液 ③氯水 ④滴有酚酞的NaOH溶液
A. ②③ B. ①② C. ①④ D. ②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com