
| A. | 1mol Na2O2与水完全反应时转移电子的数为2NA | |
| B. | 常温下,100mL 1mol•L-1 Na2CO3溶液中CO${\;}_{3}^{2-}$离子数为0.1NA | |
| C. | 1mol FeCl3与足量水反应转化为氢氧化铁胶体后,其中胶体粒子数为NA | |
| D. | 一定条件下催化分解80g SO3,混合气体中氧原子数为3NA |
分析 A、过氧化钠和水的反应为歧化反应;
B、CO32-为弱酸根,在溶液中会水解;
C、一个胶粒是多个氢氧化铁的聚集体;
D、求出三氧化硫的物质的量,然后根据原子个数守恒来分析.
解答 解:A、过氧化钠和水的反应为歧化反应,故1mol过氧化钠转移1mol电子即NA个,故A错误;
B、CO32-为弱酸根,在溶液中会部分水解为HCO3-和H2CO3,故溶液中CO32-的个数小于0.1NA个,故B错误;
C、一个胶粒是多个氢氧化铁的聚集体,故1mol氯化铁所形成的胶粒的个数小于NA个,故C错误;
D、80g三氧化硫的物质的量为1mol,含3mol氧原子,在分解过程中满足氧原子个数守恒,故分解后所得的混合气体中氧原子的个数恒为3NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
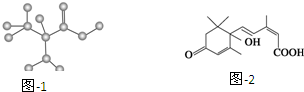
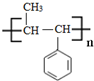
| A. | 苯环上有两个取代基的C9H12,其苯环上一氯代物的同分异构体(不考虑立体异构)共有10种 | |
| B. | 2,2二甲基丙醇与 2甲基丁醇互为同分异构体 | |
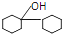
| C. | 某只含有C、H、O、N的有机物的简易球棍模型如图1所示,该有机物CH3CH2CH2NO2互为同系物 | |
| D. | S诱抗素的分子结构如图2所示,则该分子的分子式为C15H20O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径的大小顺序:r(B)>r(C)>r(D) | |
| B. | C的最高价氧化物对应水化物的碱性在同周期中最强 | |
| C. | E分别与A、C形成的化合物中化学键类型相同 | |
| D. | B的简单气态氢化物的热稳定性比D的弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
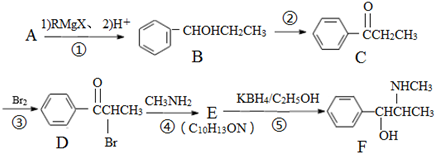
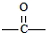 +R-Mgx→
+R-Mgx→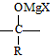 $\stackrel{H+/H_{2}O}{→}$
$\stackrel{H+/H_{2}O}{→}$ (R代表烃基,X代表卤素原子)
(R代表烃基,X代表卤素原子)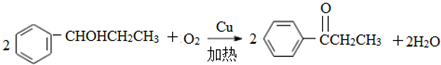 .
. .
. 是合成感冒药物中的一种原料,实验室可用环己烯按以下合成路线合成该有机物:
是合成感冒药物中的一种原料,实验室可用环己烯按以下合成路线合成该有机物: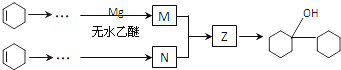
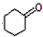 ;Z
;Z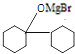 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向上述NaOH溶液中通入SO2:2OH-+SO2═SO32-+H2O | |
| B. | 上述反应后所得溶液的PH约为12:SO32-+H2O?HSO3-+OH- | |
| C. | 向上述反应后所得溶液中通入氯气,PH下降:SO32-+Cl2+2OH-═SO42-+2Cl-+H2O | |
| D. | 向上述反应后所得溶液中滴加少量H2O2和BaCl2溶液的混合液,产生白色沉淀:SO32-+Ba2++H2O2═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
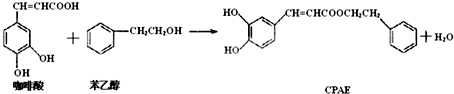
| A. | 咖啡酸分子中所有原子可能处在同一个平面上 | |
| B. | 通常条件下,咖啡酸和苯乙醇都能发生取代、加成、消去、氧化反应 | |
| C. | 1molCPAE与H2反应,最多可消耗8molH2 | |
| D. | 可用FeCl3溶液检测上述反应是否有CPAE生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
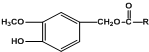 (R为烃基).其中一种辣椒素酯类化合物J的合成路线如下:
(R为烃基).其中一种辣椒素酯类化合物J的合成路线如下:
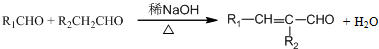
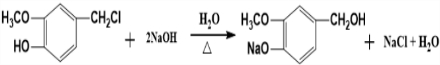 .
. .
.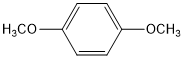 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:实验题
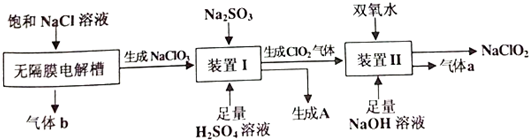
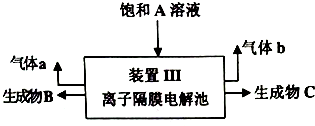

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com