
【题目】将一定质量的镁、铝合金投入一定浓度的100 mL盐酸中,使合金全部溶解,向所得溶液中滴加5.00 mol/L的NaOH溶液至过量,生成沉淀的质量与加入NaOH溶液的体积的关系如图所示。
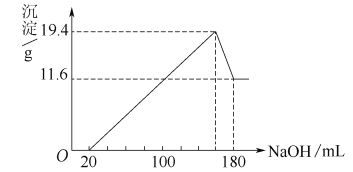
试求:(1)原合金中铝的质量分数。
(2)盐酸的物质的量浓度。
【答案】(1)36% (2)8mol/L
【解析】
试题分析:(1)由图可知,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中盐酸溶解Mg、Al后有剩余,此时发生的反应为:HCl+NaOH=NaCl+H2O.继续滴加NaOH溶液,到沉淀量最大,此时为Mg(OH)2和Al(OH)3,二者质量之和为19.4g,溶液为氯化钠溶液.再继续滴加NaOH溶液,到沉淀量开始进行,到沉淀量最小时,沉淀为Mg(OH)2,质量为11.6g,故到沉淀量最大,Al(OH)3的质量为19.4g-11.6g=7.8g.
由元素守恒可知,n(Al)=n[Al(OH)3]=7.8g÷78g/mol=0.1mol,
所以m(Al)=0.1mol×27g/mol=2.7g,
n(Mg)=n[Mg(OH)2]=11.6g÷58g/mol=0.2mol,
所以m(Mg)=0.2mol×24g/mol=4.8g,
合金中铝的质量分数为2.7g÷(4.8g+2.7g)×100%=36%;
(2)加入20mLNaOH溶液,恰好中和剩余的盐酸,此时溶液中溶质为AlCl3、MgCl2、NaCl,
根据氯元素守恒有n(HCl)=3n(AlCl3)+2n(MgCl2)+n(NaCl),
根据钠元素守恒此时溶液中n(NaCl)=n(NaOH)=0.02L×5mol/L=0.1mol,所以
n(HCl)=3n(AlCl3)+2n(MgCl2)+n(NaCl)=3×0.1mol+2×0.2mol+0.1mol=0.8mol,
原盐酸的物质的量浓度为0.8mol÷0.1L=8mol/L。


科目:高中化学 来源: 题型:
【题目】某地环保部门取一定量某工厂所排废水试样分成甲、乙、丙、丁四份,进行如图所示探究。
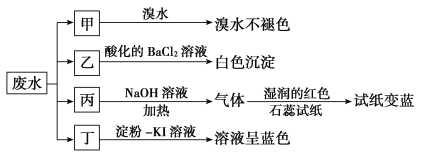
已知废水试样中可能含有下表中的离子:
离子 | |
阳离子 | Na+、Mg2+、X |
阴离子 | Cl-、SO |
请回答下列问题:
(1)离子X是________(填化学式,下同),离子Y是________。
(2)表中不能确定是否存在的阴离子是________,能证明该阴离子是否存在的简单实验操作为_____________________________。
(3)写出废水试样中滴加淀粉KI溶液所发生反应的离子方程式:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同固态物质分子1 mol,体积大小并不相同,主要原因是( )
A. 微粒大小不同 B. 微粒质量不同 C. 微粒间平均距离不同 D. 微粒间引力不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在NaCl、MgSO4、 MgCl2这三种盐配成的混合溶液中,若Na+ 的浓度为0.1mol/L、Mg2+的浓度为0.25mol/L、Cl-的浓度为0.2mol/L,则SO42-的物质的量浓度为( )
A.0.5molL-1 B.0.45molL-1 C.0.2molL-1 D.0.25molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】选择萃取剂将碘水中的碘萃取出来,这种萃取剂应具备的性质是( )B
A.不溶于水,且必须易与碘发生化学反应 B.不溶于水,且必须比水密度小
C.不溶于水,且必须比水密度大 D.不溶于水,且比水更容易使碘溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TiO2在工业生产和日常生活中有重要用途。
工业上用钛铁矿(主要成分是TiO2、少量FeO和Fe2O3)制备TiO2,再用TiO2制备TiCl4等产品的一种工艺流程如图所示:
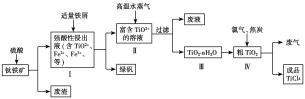
已知:TiO2+发生水解反应的化学方程式为TiO2++(n+1)H2O![]() TiO2·nH2O+2H+。
TiO2·nH2O+2H+。
(1)硫酸与TiO2反应的离子方程式是_________________________。
(2)由TiO2制取TiCl4时涉及的反应有:
TiO2(s)+2Cl2(g)+2C(s)===TiCl4(g)+2CO(g) ΔH1=-72 kJ·mol-1;
TiO2(s)+2Cl2(g)===TiCl4(g)+O2(g)
ΔH2=+38.8 kJ·mol-1;
C(s)+CO2(g)===2CO(g)
ΔH3=+282.8 kJ·mol-1。
①反应C(s)+CO2(g)===2CO(g)在高温下能够自发进行的原因是____________________。
②反应C(s)+O2(g)===CO2(g)的ΔH=________。
(3)向Ⅰ中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:2Fe3++Fe===3Fe2+;2TiO2+(无色)+Fe+4H+===2Ti3+(紫色)+Fe2++2H2O;Ti3+(紫色)+Fe3++H2O===TiO2+(无色)+Fe2++2H+。
①结合信息判断Fe3+、TiO2+、Fe2+的氧化性强弱关系:________>________>________。
②加入铁屑的作用是_____________________。
(4)向Ⅱ中不断通入高温水蒸气,维持溶液沸腾一段时间,析出水合二氧化钛沉淀。请用化学平衡理论分析通入高温水蒸气的作用:_________________________。
(5)依据绿色化学理念,该工艺流程中存在的不足之处是_________________________(写出一条即可)。
(6)工业上可通过电解TiO2来获得Ti(同时产生O2):处理过的TiO2为阴极,石墨为阳极,熔融CaCl2为电解液,电解槽中加入炭块。阴极反应式为_____________________;
电解过程中需定期向电解槽中加入炭块的原因是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是 。
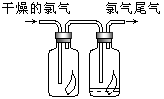
(2)为防止氯气尾气污染空气,根据氯水显酸性的性质,可用 溶液吸收多余的氯气,原理是(用化学方程式表示)______________________________。
(3)根据这一原理,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是__________(填化学式),长期露置于空气中的漂白粉,加稀盐酸后产生的气体是__________(用字母代号填)。
A.O2 B.H2 C.CO2 D.HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
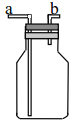
(1)排空气法收集气体,若收集 CO2气体,进气口为____________(填“a”或“b”)
(2)若瓶中装满水,可用于收集下列气体中的_____________(选填编号)
①NO ②NO2③NH3④HCl
(3)如果广口瓶中盛放浓硫酸,可以用作气体干燥装置,则该装置不可以干燥的气体有_________(选填编号)
①HCl ②H2③NH3④CO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com