
【题目】化学是以实验为基础的学科。
(1)下列有关实验叙述正确的是________(填序号)。
a.试管、烧杯均可用于给液体、固体加热
b.使食盐水中NaCl结晶析出时,常用到的仪器有坩埚、酒精灯、玻璃棒、泥三角
c.用铁坩埚灼烧烧碱
d.分液时,下层液体先从分液漏斗下口放出,换一个接收容器,再将上层液体从分液漏斗下口放出
e.用托盘天平称取25.20g氯化钠
f.取用金属钠或钾时,没用完的钠或钾要放回原瓶
(2)实验室用密度为1.25g/mL,质量分数为36.5%的浓盐酸配制240mL 0.1mol/L的盐酸,应量取浓盐酸体积________mL。使用的仪器除玻璃棒、烧杯、量筒外,还需要_______。
【答案】cf 2.0 250mL的容量瓶、胶头滴管
【解析】
(1)依据实验基本操作步骤作答;
(2)先依据c=![]() 计算浓盐酸的物质的量浓度,实验室无240mL容量瓶,故应选择250mL容量瓶,配制出250mL的溶液,根据溶液稀释前后所含溶质的物质的量不变计算需要浓盐酸的体积;再结合配制过程选择所需仪器。
计算浓盐酸的物质的量浓度,实验室无240mL容量瓶,故应选择250mL容量瓶,配制出250mL的溶液,根据溶液稀释前后所含溶质的物质的量不变计算需要浓盐酸的体积;再结合配制过程选择所需仪器。
(1)a. 试管可用于给液体、固体加热,但烧杯只能用于液体加热,a项错误;、
b. 使食盐水中NaCl结晶析出的操作是蒸发浓缩、冷却结晶,所用到的仪器蒸发皿、酒精灯、玻璃棒、泥三角,而不是坩埚,b项错误;
c. 普通玻璃或陶瓷坩埚都含有二氧化硅,能与烧碱反应,而铁坩埚不会与烧碱反应,因此用铁坩埚灼烧烧碱,c项正确;
d. 分液时,为避免上下液体混合,则分液漏斗先从下口放出下层液体,再从上口倒出上层液体,d项错误;
e. 托盘天平的精确度为![]() 0.1g,不能称取25.20g氯化钠,e项错误;
0.1g,不能称取25.20g氯化钠,e项错误;
f. 取用金属钠或钾时,没用完的钠或钾要放回原瓶,需妥善保管,f项正确;
答案为cf;
(2)浓盐酸的物质的量浓度c=![]() =
=![]() =12.5mol/L,要配置240mL的溶液,应选择250mL的容量瓶,设需要浓盐酸的体积为V,依据溶液稀释前后所含溶质的物质的量不变得V×12.5mol/L = 250mL×0.1mol/L,解得V=2.0mL;根据配制一定物质的量浓度溶液的步骤为计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶可知,使用的仪器除玻璃棒、烧杯、量筒外,还需要250mL的容量瓶、胶头滴管。
=12.5mol/L,要配置240mL的溶液,应选择250mL的容量瓶,设需要浓盐酸的体积为V,依据溶液稀释前后所含溶质的物质的量不变得V×12.5mol/L = 250mL×0.1mol/L,解得V=2.0mL;根据配制一定物质的量浓度溶液的步骤为计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶可知,使用的仪器除玻璃棒、烧杯、量筒外,还需要250mL的容量瓶、胶头滴管。


科目:高中化学 来源: 题型:
【题目】现有下列9种物质:①氯气;②二氧化硫;③稀硫酸;④铁;⑤BaCl2固体;⑥氢氧化钾;⑦KNO3溶液;⑧酒精(C2H5OH);⑨氧化钙,请将上述物质按要求完成下列问题:
(1)用相应化学式填写下列空白:属于酸性氧化物的有_____________,属于碱性氧化物的有____________,属于电解质的是______,属于非电解质的是_______。(用序号填空)
(2)写出NaHCO3电离方程式:______
(3)用双线桥表示Cl2与二氧化硫的反应________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度时,N2与H2反应过程中能量变化的曲线如图,其中a表示不使用催化剂时的能量变化曲线,b表示使用催化剂时的能量变化曲线。下列叙述正确的是

A. 状态M和N均表示2molN(g)+6mol H(g)
B. 该反应的热化学方程式为:N2+3H2![]() 2NH3 △H=-92kJ·mol-l
2NH3 △H=-92kJ·mol-l
C. 使用催化剂,降低了反应进行所需的最低能量,增大了反应放出的能量
D. 使用催化剂,并不能改变反应的△H
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(加试题)
(一)以一氯代乙酸钠(CH2ClCOONa)水溶液为原料,通过电解法可以制备1,2-二氯乙烷(CH2ClCH2Cl),装置如图1所示。
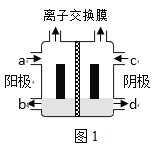
(1)所用的离子交换膜是___(填“阳”或“阴”)离子交换膜。
(2)写出电解池总反应___。
(二)1940年,我国著名化工专家侯德榜先生成功冲破了“索尔维”法的技术封锁,并加以改进,用NaCl固体代替生石灰,加入母液,并联合合成氨厂一起生产出纯碱和氯化铵。这便是举世闻名的“侯氏联合制碱法”,工艺流程如图2。
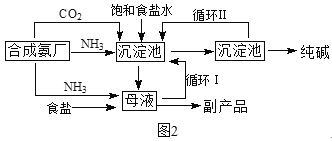
请回答:
(1)关于合成氨反应,下列说法合理的是___。
A.反应体系中一般用V2O5作催化剂
B.因为该反应ΔS小于零,所以反应的ΔH一定也小于零
C.因为该反应的ΔS小于零,所以反应的压强控制越高越好
D.该反应往往控制在500℃左右,是因为该温度下反应物转化率最高
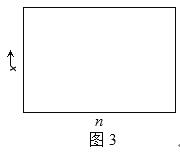
(2)一定温度下合成氨反应的平衡常数K=48。若在该温度下,在9L的恒容容器中投入1mol氮气和3mol氢气进行反应,则氨气的平衡产率y=___;若氮气和氢气的物质的量之比为n∶1,相应平衡体系中氨气的物质的量分数为x,请在图3中绘制x随n变化的示意图(计算时不计副反应)。______
(3)侯氏制碱法最大的优点是使原料氯化钠的利用率从70%提高到90%以上,主要是设计了____(填上述编号)的循环。
(4)关于侯氏联合制碱法,下列说法合理的是_____。
A.往沉淀池中先通入CO2再通入氨气的目的是提高NaHCO3的产量
B.往母液中加入食盐的目的是使NaHCO3更多地析出
C.从母液中经过循环Ⅰ进入沉淀池的主要是Na2CO3、NH4Cl和氨水
D.往母液中通氨气目的仅仅是增大NH4+的浓度,使NH4Cl更多地析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质变化和分类的说法正确的是( )
A. 胆矾、冰水混合物、四氧化三铁都不是混合物
B. 电解熔融态的Al2O3、12C转化为14C都属于化学变化
C. 葡萄糖溶液和淀粉溶液的本质区别是能否产生丁达尔效应
D. SiO2、NO2、Al2O3都属于酸性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分离提纯是化学实验中的重要部分,方法有过滤、蒸发、萃取、蒸馏等,应用广泛,环己醇脱水是合成环己烯的常用方法,实验室合成环己烯的反应和实验装置如图:
![]()

可能用到的有关数据如下:

Ⅰ.合成反应:
在a中加入20 g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90 ℃。
Ⅱ.分离提纯:
反应粗产物倒入分液漏斗中分别用少量5 %碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯10 g。
回答下列问题:
(1)装置b的名称是__。
(2)加入碎瓷片的作用是__;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是__(填字母)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)分液漏斗在使用前须清洗干净并__;在本实验分离过程中,产物应该从分液漏斗的__(填“上口倒出”或“下口倒出”)。
(4)分离提纯过程中加入无水氯化钙的目的是__。
(5)在环己烯粗产物蒸馏过程中,不可能用到的仪器有__(填正确答案标号)。
A.蒸馏烧瓶 B.温度计 C.分液漏斗 D.牛角管 E.锥形瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. ![]() 属于同分异构体
属于同分异构体
B. CH3COOCH2CH3与CHI3CH2COOCH3中均含有甲基、乙基和酯基,为同一种物质
C. C60与14C互为同素异形体
D. 乙酸与硬脂酸互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中央电视台报道联华超市在售的某品牌鸡蛋为“橡皮弹”,专家介绍,这是由于鸡饲料里添加了棉籽饼,从而使鸡蛋里含有过多棉酚所致。其结构简式如图:下列说法不正确的是( )
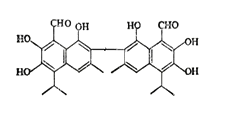
A. 该化合物的分子式为:C30H30O8
B. 1mol棉酚最多可与10mol H2加成,与6molNaOH反应
C. 在一定条件下,可与乙酸反应生成酯类物质
D. 该物质可以使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一混合物的水溶液,只可能含有以下离子中的若干种:K+、![]() 、Cl-、Mg2+、Ba2+、
、Cl-、Mg2+、Ba2+、![]() 、
、![]() ,现取三份100mL溶液进行如下实验:
,现取三份100mL溶液进行如下实验:
第一份加入AgNO3溶液有沉淀产生;
第二份加足量NaOH溶液加热后,收集到0.08mol气体;
第三份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g。
(已知, ![]() +OH-
+OH-![]() H2O+NH3↑)
H2O+NH3↑)
根据上述实验,回答以下问题。
(1)由第一份进行的实验推断该混合物是否一定含有Cl-?____________(答是或否)。
(2)由第二份进行的实验得知混合物中应含有____________(填离子符号),其物质的量浓度为____________。
(3)由第三份进行的实验可知12.54g沉淀的成分为____________。
(4)综合上述实验,你认为以下结论正确的是(______)
A.该混合液中一定含有K+、![]() 、
、![]() 、
、![]() ,可能含Cl-,且n(K+)≥0.04mol
,可能含Cl-,且n(K+)≥0.04mol
B.该混合液中一定含有![]() 、
、![]() 、
、![]() ,可能含K+、Cl-
,可能含K+、Cl-
C.该混合液中一定含有![]() 、
、![]() 、
、![]() ,可能含Mg2+、K+、Cl-
,可能含Mg2+、K+、Cl-
D.该混合液中一定含有![]() 、
、![]() ,可能含Mg2+、K+、Cl-
,可能含Mg2+、K+、Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com