
����Ŀ��Ϊ̽��FeCl3��Һ�е�����ƽ������ӷ�Ӧ��ijС��ͬѧ����������ʵ�顣
��1������50 mL 1.0 mol��L1��FeCl3��Һ������pHԼΪ0.7����c(H+) = 0.2 mol��L1��
�� �û�ѧ�������FeCl3��Һ�����Ե�ԭ�� ��
�� ����ʵ�鷽���У���ʹFeCl3��ҺpH���ߵ��� ������ĸ��ţ���
a. ��ˮϡ�� b. ����FeCl3����
c. �μ�ŨKSCN��Һ d. ����NaHCO3����
��2��С��ͬѧ��������FeCl3��Һ̽����������п�۵ķ�Ӧ��ʵ��������������£�
���� | ���� |
��Ӧƿ�м���6.5 gп�ۣ�Ȼ�����50 mL 1.0 mol��L1��FeCl3��Һ������ | ��Һ�¶�Ѹ���������Ժ���ֺ��ɫ������ͬʱ�����������ݣ���Ӧһ��ʱ����ã��ϲ���ҺΪdz��ɫ����Ӧƿ�ײ��к�ɫ���� |
�ռ����鷴Ӧ�����в��������� | �����ܿڿ������棬�б����� |
��֪��Zn��������Al���ƣ��ܷ�����Ӧ��Zn + 2NaOH = Na2ZnO2 + H2 ��
�� ���ʵ�������ƽ���ƶ�ԭ�����ͳ��ֺ��ɫ������ԭ�� ��
�� �����ӷ���ʽ���ͷ�Ӧ����ҺΪdz��ɫ��ԭ�� ��
�� �������ɫ���壬������ʵ��֤ʵ�����к��е���Ҫ���ʡ�
i. ��ɫ������Ա�����������
ii. ���ɫ�����м���������NaOH��Һ���������ݣ�
iii. ��ii��ʣ�����������ˮϴ�Ӻ���ϡ���ᣬ�����������ݣ�
iv. ��iii��Ӧ�����Һ�еμ�KSCN��Һ���ޱ仯��
a. ��ɫ������һ�����е������� ��
b. С��ͬѧ��Ϊ����ʵ����ȷ����ɫ�������Ƿ���Fe3O4�������� ��
��3��Ϊ��һ��̽������1.0 mol��L1 FeCl3��Һ��Fe3+��H+�����Ե����ǿ��������ʵ�鲢�۲쵽��Ӧ��ʼʱ�������£�
���� | ���� |
��5 mL 1.0 mol��L1��FeCl3��Һ��0.65 gп�ۻ�� | ��Һ�¶�Ѹ����������ʼʱ����û������ |
�� ��0.65 gп�ۻ�� | ��Һ������������������ |
С��ͬѧ�ó����ۣ���1.0 mol��L1 FeCl3��Һ�У�Fe3+�������Ա�H+��ǿ��
���𰸡�
��1���� Fe3+ + 3H2O![]() Fe(OH)3 + 3H+���� acd
Fe(OH)3 + 3H+���� acd
��2���� ��Һ�¶����ߣ���Ӧ�����г���H2ʹ��Һ��c(H+)�����������ٽ�Fe3+ + 3H2O ![]() Fe(OH)3 + 3H+�����ƶ������ֺ��ɫFe(OH)3�������� 2Fe3+ + Zn = 2Fe2+ + Zn2+���� a. Fe��Zn��b. iii�У�������Fe3O4��ϡ������Fe3O4��Ӧ������Fe3+����Fe������Ӧ����Fe2+��������iv�м�ⲻ��Fe3+����û��Fe3O4�õ���iv��������ͬ
Fe(OH)3 + 3H+�����ƶ������ֺ��ɫFe(OH)3�������� 2Fe3+ + Zn = 2Fe2+ + Zn2+���� a. Fe��Zn��b. iii�У�������Fe3O4��ϡ������Fe3O4��Ӧ������Fe3+����Fe������Ӧ����Fe2+��������iv�м�ⲻ��Fe3+����û��Fe3O4�õ���iv��������ͬ
��3��5 mL 0.2 mol��L-1����pH = 0.7�������� ���ɲ�����Cl-�Է�Ӧ��Ӱ�죩
��������
�����������1����FeCl3��Һ����������Ϊ�Ȼ���ˮ��Ľ�����ʴ�Ϊ��Fe3+ + 3H2O![]() Fe(OH)3 + 3H+��
Fe(OH)3 + 3H+��
�� a. ��ˮϡ�ͣ����ܴٽ��Ȼ���ˮ�⣬��������Ũ�ȼ�С��pH������ȷ��b. ����FeCl3���壬�Ȼ�����Һ��Ũ������ˮ��̶ȼ�С����������Ũ������pH��С������c. �μ�ŨKSCN��Һ��ʹ��������Ũ�ȼ�С��Fe3+ + 3H2O![]() Fe(OH)3 + 3H+�����ƶ������Լ�����pH������ȷ��d. ����NaHCO3���壬ʹ��������Ũ�ȼ�С��pH������ȷ����ѡacd��
Fe(OH)3 + 3H+�����ƶ������Լ�����pH������ȷ��d. ����NaHCO3���壬ʹ��������Ũ�ȼ�С��pH������ȷ����ѡacd��
��2������Һ�¶����ߣ���Ӧ�����г���H2ʹ��Һ��c(H+)�����������ٽ�Fe3+ + 3H2O ![]() Fe(OH)3 + 3H+�����ƶ������ֺ��ɫFe(OH)3�������ʴ�Ϊ����Һ�¶����ߣ���Ӧ�����г���H2ʹ��Һ��c(H+)�����������ٽ�Fe3+ + 3H2O
Fe(OH)3 + 3H+�����ƶ������ֺ��ɫFe(OH)3�������ʴ�Ϊ����Һ�¶����ߣ���Ӧ�����г���H2ʹ��Һ��c(H+)�����������ٽ�Fe3+ + 3H2O ![]() Fe(OH)3 + 3H+�����ƶ������ֺ��ɫFe(OH)3������
Fe(OH)3 + 3H+�����ƶ������ֺ��ɫFe(OH)3������
�� п�������ӷ���������ԭ��Ӧ�����������ӣ�ʹ����Ӧ����ҺΪdz��ɫ���ʴ�Ϊ��2Fe3+ + Zn = 2Fe2+ + Zn2+��
��a. ��ɫ������Ա���������˵�������������ɫ�����м���������NaOH��Һ���������ݣ�˵������п�������ɫ������һ������п���ʴ�Ϊ��Fe��Zn��
b. iii�У�������Fe3O4��ϡ������Fe3O4��Ӧ������Fe3+����Fe������Ӧ����Fe2+��������iv�м�ⲻ��Fe3+����û��Fe3O4�õ���iv��������ͬ���ʴ�Ϊ��iii�У�������Fe3O4��ϡ������Fe3O4��Ӧ������Fe3+����Fe������Ӧ����Fe2+��������iv�м�ⲻ��Fe3+����û��Fe3O4�õ���iv��������ͬ��
��3��Ҫʹ����Һ�����������������ݣ�������5 mL 0.2 mol��L-1��������п��Ӧ������̽��Ŀ�ģ��Ƚ�1.0 mol��L1 FeCl3��Һ��Fe3+��H+�����Ե����ǿ������5 mL 1.0 mol��L1��FeCl3��Һ��0.65 gп�ۻ�ϣ���Һ�¶�Ѹ����������ʼʱ����û�����ݣ�˵��������������п��������ԭ��Ӧ��������ˮ�����ɵ���������п��Ӧ���Ӷ�˵����1.0 mol��L1 FeCl3��Һ�У�Fe3+�������Ա�H+��ǿ���ʴ�Ϊ��5 mL 0.2 mol��L-1�����ᡣ



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������̫�����Ȼ�ѧ���ѭ���ֽ�ˮ���ⷴӦ��������ͼ��ʾ��
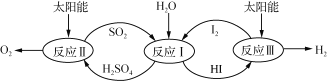
(1) ��Ӧ�����漰���Ȼ�ѧ����ʽΪ��
��H2SO4(l)=SO3(g)��H2O(g) ��H����177.3 kJ��mol��1
��2SO3(g) = 2SO2(g)��O2(g) ��H��a kJ��mol��1
��2H2SO4(l)=2SO2(g)��O2(g)��2H2O(g) ��H����550.2 kJ��mol��1�� a�� ��
(2)��Ӧ���õ��IJ������I2���з��롣�ò������Һ�ڹ���I2�Ĵ����»�ֳ����� ������Ũ��I2��H2SO4��Һ���Ũ�ȵ�I2��HI��Һ�㡣
������������Һ�ɼ�����Լ�Ϊ (�ѧʽ)��
������˵����ȷ���� (�����)��
A. SO2�ڷ�Ӧ������������
B. �ӹ���I2ǰ��H2SO4��Һ��HI������
C. ������Һ���ܶȴ��ڲ���
D. I2��HI��Һ�б���H2SO4��Һ������
(3)����ȱλ����ͭ(CuFe2O4��x)������������̫�����Ȼ�ѧѭ���ֽ�H2OҲ����H2��������ת������ͼ��ʾ��
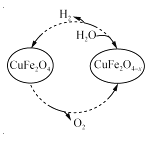
����ȱλ����ͭ(CuFe2O4��x)��ˮ��Ӧ�Ļ�ѧ����ʽΪ ��
����x��0.15����1 mol CuFe2O4�����ѭ������������һ�����Ƶñ�״���µ�H2���Ϊ L��
��CuFe2O4���õ绯ѧ�����õ�����ԭ����ͼ��ʾ���������ĵ缫��ӦʽΪ ��
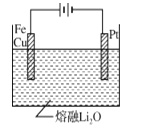
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����չŴ���ѧ�ҷ��������䡶����Сʶ�����ߡ���ʯ�ࡷ��ָ��������ˮ�ߣ�������Ͷ֮��������Ϊˮ�����е�����ˮ��ָ ( )
A. ���� B. ���� C. ���� D. ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A(g)+B(g)![]() C(g)+D(g)��Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£�
C(g)+D(g)��Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£�
�¶�/ �� | 700 | 800 | 830 | 1000 | 1200 |
ƽ�ⳣ�� | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
830��ʱ����һ��2 L���ܱ������г���0.2mol��A��0.8mol��B����Ӧ��ʼ4 s��A��ƽ����Ӧ����v(A)=0.005mol/(L��s)������˵����ȷ����
A. 4 sʱc(B)Ϊ0.38 mol/L
B. 830���ƽ��ʱ��A��ת����Ϊ20%
C. ��Ӧ��ƽ��������¶ȣ�ƽ�������ƶ�
D. 1200��ʱ��ӦC(g)+D(g)![]() A(g)+B(g)��ƽ�ⳣ��Ϊ0.4
A(g)+B(g)��ƽ�ⳣ��Ϊ0.4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������ʻ�Ϊͬϵ����� �� ��
A. Ӳ֬�����֬�� B. ���������
C. ���������Ӳ֬������� D. C6H5��CH2OH��C6H5��OH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ճ������е��������ʣ����ںϳɲ��ϵ��� �� ��
A����ë B.���� C.������ D.��˿��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ͭ����ƽ�⣺Cu(OH)2 + 2OH��![]() Cu(OH)42��������ɫ����ijͬѧ��������ʵ�飺
Cu(OH)42��������ɫ����ijͬѧ��������ʵ�飺
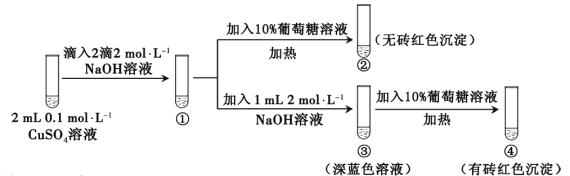
����˵������ȷ����
A. ���г�����ɫ����
B. ����������Cu(OH)2 + 2OH��![]() Cu(OH)42�������ƶ��Ľ��
Cu(OH)42�������ƶ��Ľ��
C. ��������֤�������Ǿ��л�ԭ��
D. �ԱȢںܿ͢�֪Cu(OH)2������ǿ��Cu(OH)42��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����5KCl+KClO3+3H2SO4��3Cl2��+3K2SO4+3H2O�У�����������Ԫ���뱻��ԭ����Ԫ�ص�������Ϊ
A. 1��1 B. 5��1 C. 1��5 D. 3��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ƿ������У����¶���Ũ����������ѹǿ���̶�������ʽ�ͼ�ʽ�����е�
A. �٢ۢ� B. �ۢݢ� C. �٢ڢ� D. �ڢܢ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com