
����Ŀ����֪A(g)+B(g)![]() C(g)+D(g)��Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£�
C(g)+D(g)��Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£�
�¶�/ �� | 700 | 800 | 830 | 1000 | 1200 |
ƽ�ⳣ�� | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
830��ʱ����һ��2 L���ܱ������г���0.2mol��A��0.8mol��B����Ӧ��ʼ4 s��A��ƽ����Ӧ����v(A)=0.005mol/(L��s)������˵����ȷ����
A. 4 sʱc(B)Ϊ0.38 mol/L
B. 830���ƽ��ʱ��A��ת����Ϊ20%
C. ��Ӧ��ƽ��������¶ȣ�ƽ�������ƶ�
D. 1200��ʱ��ӦC(g)+D(g)![]() A(g)+B(g)��ƽ�ⳣ��Ϊ0.4
A(g)+B(g)��ƽ�ⳣ��Ϊ0.4
���𰸡�A
�����������������A����Ӧ��ʼ4s��A��ƽ����Ӧ����v(A)=0.005mol/(Ls)������֮�ȵ��ڻ�ѧ������֮�ȣ�����v(B)=v(A)=0.005mol/(Ls)����4s����c(B)=0.005molL-1s-1��4s=0.02mol/L��B����ʼŨ��Ϊ![]() =0.4mol/L����4sʱc(B)=0.4mol/L-0.02mol/L=0.38mol/L����A��ȷ��B����ƽ��ʱA��Ũ�ȱ仯��Ϊx����
=0.4mol/L����4sʱc(B)=0.4mol/L-0.02mol/L=0.38mol/L����A��ȷ��B����ƽ��ʱA��Ũ�ȱ仯��Ϊx����
A(g)+B(g)![]() C(g)+D(g)
C(g)+D(g)
��ʼ(mol/L)��0.1 0.4 0 0
�仯(mol/L)��x x x x
ƽ��(mol/L)��0.1-x 0.4-x x x
��![]() =1�����x=0.08������ƽ��ʱA��ת����Ϊ
=1�����x=0.08������ƽ��ʱA��ת����Ϊ![]() ��100%=80%����B����C���ɱ����֪���¶����ߣ���ѧƽ�ⳣ����С��ƽ�������ƶ������������ƶ�����C����D.1200��ʱ��ӦA(g)+B(g)C(g)+D(g)��ƽ�ⳣ��ֵΪ0.4������1200��ʱ��ӦC(g)+D(g)A(g)+B(g)��ƽ�ⳣ����ֵΪ
��100%=80%����B����C���ɱ����֪���¶����ߣ���ѧƽ�ⳣ����С��ƽ�������ƶ������������ƶ�����C����D.1200��ʱ��ӦA(g)+B(g)C(g)+D(g)��ƽ�ⳣ��ֵΪ0.4������1200��ʱ��ӦC(g)+D(g)A(g)+B(g)��ƽ�ⳣ����ֵΪ![]() =2.5����D����ѡA��
=2.5����D����ѡA��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͨ���ܽ⡢���ˡ������Ȳ������ɽ����и�������������( )
A. �����ơ��������� B. ����ͭ����������
C. �Ȼ��ء��������� D. ����ͭ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CuSO4��һ����Ҫ�Ļ���ԭ�ϣ����й��Ʊ�;����������ͼ��ʾ������˵����ȷ����
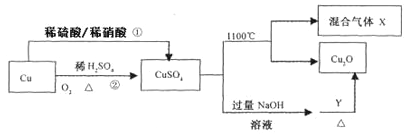
A��;������;��������������������Ժ�������
B��Y�����Ǿƾ���Һ
C��CuSO4��1100���ֽ���������X������SO2��SO3�Ļ������
D����CuSO4��Һ����Ũ������ȴ�ᾧ�����Ƶõ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������[aFe2(SO4) 3��b(NH4) 2SO4��cH2O]�㷺���ڳ�����������ˮ����ҵѭ��ˮ�ľ��������ȡ�ij����������������������������ƣ��������Ϊԭ�ϣ���������¹���������ȡ������李�
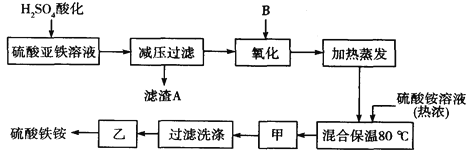
��ش��������⣺
��1���������������ʺϵ�������B�� ��
a��NaClO b��H2O2c��KMnO4d��K2Cr2O7
��Ӧ�����ӷ���ʽ ��
��2�����������У����������ʺϵ�������B����֮��ͼ�������֮ǰ����ȡ��������Fe2+�Ƿ���ȫ�����������ܷ������Ե�KMnO4��Һ����˵������ �����������ֻ�ʽ˵����
��3���������������NH4+�ķ����� ��
��4����ȡ14.00 g������Ʒ����������ˮ���Ƴ�100 mL��Һ���ֳ����ȷݣ�������һ���м�������NaOH��Һ������ϴ�ӵõ�2.14 g����������һ����Һ�м��뺬0.05 mol Ba (NO3)2����Һ��ǡ����ȫ��Ӧ�����������淋Ļ�ѧʽΪ______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijЩ�л��������ģ����ͼ��ʾ��
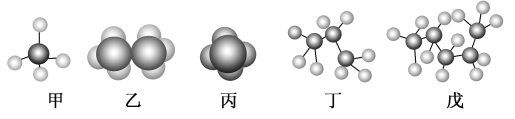
�ش��������⣺
(1)���ڱ���ģ�͵���________(��ס������ҡ��������������������족����ͬ)��
(2)��ʾͬһ���л����������____________��
(3)����ͬ���칹�����___________��д����ͬ���칹��Ľṹ��ʽ________________________��
(4)��̼����͵���________����������͵ķ�������Ԫ�ص�����������________(����һλС��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾΪ4��̼ԭ�����ϵķ�ʽ��С���ʾ̼ԭ�ӣ�С����ʾ��ѧ��������̼ԭ��������Ļ�ѧ��������ԭ�ӽ�ϡ�

(1)ͼ��������������_____________(����ĸ����ͬ)��
(2)������ͼ��ʾ���л��������У�̼ԭ����̼ԭ��֮�䲻�������γɵ������������γ�_____________��_____________�����������γ�_____________���������γ�̼����
(3)����˫������_____________��������������_____________��
(4)ͼ�л�Ϊͬ���칹����ǣ�A��________��B��________��D��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ̽��FeCl3��Һ�е�����ƽ������ӷ�Ӧ��ijС��ͬѧ����������ʵ�顣
��1������50 mL 1.0 mol��L1��FeCl3��Һ������pHԼΪ0.7����c(H+) = 0.2 mol��L1��
�� �û�ѧ�������FeCl3��Һ�����Ե�ԭ�� ��
�� ����ʵ�鷽���У���ʹFeCl3��ҺpH���ߵ��� ������ĸ��ţ���
a. ��ˮϡ�� b. ����FeCl3����
c. �μ�ŨKSCN��Һ d. ����NaHCO3����
��2��С��ͬѧ��������FeCl3��Һ̽����������п�۵ķ�Ӧ��ʵ��������������£�
���� | ���� |
��Ӧƿ�м���6.5 gп�ۣ�Ȼ�����50 mL 1.0 mol��L1��FeCl3��Һ������ | ��Һ�¶�Ѹ���������Ժ���ֺ��ɫ������ͬʱ�����������ݣ���Ӧһ��ʱ����ã��ϲ���ҺΪdz��ɫ����Ӧƿ�ײ��к�ɫ���� |
�ռ����鷴Ӧ�����в��������� | �����ܿڿ������棬�б����� |
��֪��Zn��������Al���ƣ��ܷ�����Ӧ��Zn + 2NaOH = Na2ZnO2 + H2 ��
�� ���ʵ�������ƽ���ƶ�ԭ�����ͳ��ֺ��ɫ������ԭ�� ��
�� �����ӷ���ʽ���ͷ�Ӧ����ҺΪdz��ɫ��ԭ�� ��
�� �������ɫ���壬������ʵ��֤ʵ�����к��е���Ҫ���ʡ�
i. ��ɫ������Ա�����������
ii. ���ɫ�����м���������NaOH��Һ���������ݣ�
iii. ��ii��ʣ�����������ˮϴ�Ӻ���ϡ���ᣬ�����������ݣ�
iv. ��iii��Ӧ�����Һ�еμ�KSCN��Һ���ޱ仯��
a. ��ɫ������һ�����е������� ��
b. С��ͬѧ��Ϊ����ʵ����ȷ����ɫ�������Ƿ���Fe3O4�������� ��
��3��Ϊ��һ��̽������1.0 mol��L1 FeCl3��Һ��Fe3+��H+�����Ե����ǿ��������ʵ�鲢�۲쵽��Ӧ��ʼʱ�������£�
���� | ���� |
��5 mL 1.0 mol��L1��FeCl3��Һ��0.65 gп�ۻ�� | ��Һ�¶�Ѹ����������ʼʱ����û������ |
�� ��0.65 gп�ۻ�� | ��Һ������������������ |
С��ͬѧ�ó����ۣ���1.0 mol��L1 FeCl3��Һ�У�Fe3+�������Ա�H+��ǿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʹ�÷�Һ©�����з�Һʱ����ȷ�IJ����ǣ� ��
A.�ϲ�Һ�徭©���·������ų�
B.����Һ��ʱ����©���������Ͻ��з���
C.����Һ��ʱ����Һ©���ϵ�С���������ͨʱ����
D.��Һ©����ʢװ����Һ�壬��Ť������������ų�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ�ʹ�ò��漰��ѧ�仯����
A������������ˮ�� B��Һ�����������
C��������ʴ���� D����ʯ���������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com