
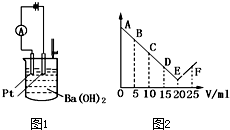
 如图1所示:将30ml 0.1mol?L-1Ba(OH)2溶液置于烧杯中,然后慢慢加入0.1mol?L-1某第三周期元素形成的某酸溶液共25mL,加入酸溶液的体积V与电流强度I的I-V图如图2所示.
如图1所示:将30ml 0.1mol?L-1Ba(OH)2溶液置于烧杯中,然后慢慢加入0.1mol?L-1某第三周期元素形成的某酸溶液共25mL,加入酸溶液的体积V与电流强度I的I-V图如图2所示.

 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
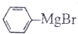 )与二苯酮反应制备三苯甲醇.
)与二苯酮反应制备三苯甲醇.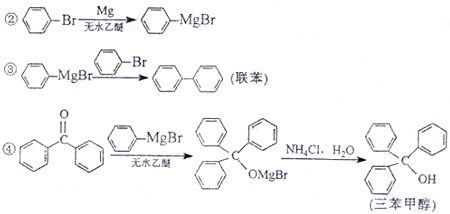
查看答案和解析>>
科目:高中化学 来源: 题型:

| 棉球 | 棉球上滴加试剂 | 实验现象 | 解释或结论 |
| a | 棉球变白, 微热后又恢复红色 |
解释: 结论:该气体具有漂白性. | |
| b | 含酚酞的NaOH溶液 | 棉球变为白色 | 离子方程式: |
| c | 棉球变为白色 | 化学方程式: 结论:该气体具有 |
| 溶液A | 固体B | 气体C | |
| a | 稀硫酸 | Zn | Cl2 |
| b | 浓盐酸 | MnO2 | H2 |
| c | 稀硝酸 | Fe | Cl2 |
| d | 浓盐酸 | KMnO4 | H2 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江西省宜春市高安中学高二(上)期中化学试卷(解析版) 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com