
【题目】为测定某碳酸钠样品的纯度,取一定质量碳酸钠样品投入到40mL未知浓度的盐酸中,两者恰好完全反应(杂质不反应),生成二氧化碳气体224mL(标准状况下)。计算:
(1)该碳酸钠样品中碳酸钠的物质的量是_____________。
(2)盐酸的物质的量浓度是____________。
【答案】0.01mol 0.5mol/L
【解析】
碳酸钠与盐酸反应的方程式为:Na2CO3+2HCl=2NaCl+CO2↑+H2O,根据反应关系Na2CO3---CO2![]() 2HCl,结合二氧化碳气体的物质的量进行相关计算。
2HCl,结合二氧化碳气体的物质的量进行相关计算。
(1) 碳酸钠与盐酸反应的方程式为:Na2CO3+2HCl=2NaCl+CO2↑+H2O,根据反应关系可知,Na2CO3![]() CO2,二氧化碳气体224mL,气体的物质的量为0.01mol,所以n(Na2CO3)=0.01mol;
CO2,二氧化碳气体224mL,气体的物质的量为0.01mol,所以n(Na2CO3)=0.01mol;
故答案是:0.01mol;
(2) 碳酸钠与盐酸反应的方程式为:Na2CO3+2HCl=2NaCl+CO2↑+H2O,盐酸与碳酸钠恰好完全反应,满足关系:2HCl![]() CO2,所以n(HCl)=0.02mol,c(HCl)=
CO2,所以n(HCl)=0.02mol,c(HCl)=![]() =0.5mol/L;
=0.5mol/L;
故答案是:0.5mol/L。


科目:高中化学 来源: 题型:
【题目】根据如图所示示意图,下列说法不正确的是( )
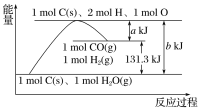
A.反应C(s)+H2O(g)=CO(g)+H2(g),能量增加(b-a)kJ·mol-1
B.该反应过程反应物断键吸收的能量大于生成物成键放出的能量
C.1molC(s)和1molH2O(l)反应生成1molCO(g)和1molH2(g)吸收的热量为131.3kJ
D.1molC(s)、2molH、1molO转变成1molCO(g)和1molH2(g)放出的热量为akJ
查看答案和解析>>
科目:高中化学 来源: 题型:
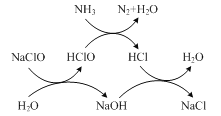
【题目】消除含氮化合物对大气和水体的污染是环境保护的重要研究课题。
(1)已知反应8NH3+6NO2=7N2+12H2O,请分析氧化产物和还原产物的质量之比为________。
(2)水体中过量氨氮(以NH3表示)会导致水体富营养化。
①用次氯酸钠除去氨氮的原理如题图所示。写出该图示的总反应化学方程式:________。
该反应需控制温度,温度过高时氨氮去除率降低的原因是________。
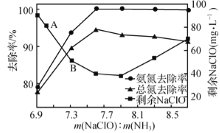
②取一定量的含氨氮废水,改变加入次氯酸钠用量,反应一段时间后,溶液中氨氮去除率、总氮(溶液中所有可溶性的含氮化合物中氮元素的总量)去除率以及剩余次氯酸钠的含量随m(NaCIO)m(NH3)的变化情况如图所示。当m( NaCIO):m(NH3)>7.6时,水体中总氮去除率反而下降,可能的原因是________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应6NO2+8NH3= 7N2+12H2O构成电池的装置如图所示。此方法既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能。下列说法正确的是:

A.电流从左侧A电极经过负载后流向右侧B电极
B.当有4.48 L NO2被处理时,转移电子数为0.8NA
C.电极A极反应式为2NH3-6e-= N2+6H+
D.为使电池持续放电,离子交换膜需选用阴离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】孔雀石等自然界存在的碳酸盐类铜矿的化学组成为xCuCO3·yCu(OH)2(x、y为正整数,且x≤3,y≤2)。
(1)现有两份等量的某碳酸盐类制矿样品,一份加足量盐酸,产生3.36L标准状况下的CO2气体,另一份加热完全分解得到20gCuO,则该碳盐类铜矿的化学组成中x:y=____。
(2)设某碳酸盐类铜矿样品质量为ag,含铜质量为bg,加酸完全分解得到标准状况下CO2气体VL,则a、b、V的代数关系式是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
A.同温同压条件下,等质量的氧气和臭氧体积比为2∶3
B.33.6 L NH3气体所含分子的物质的量为1.5 mol
C.常温常压下,22 g CO2所含有的分子数为0.5NA
D.标准状况下,11.2 L水中含有的分子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为蒸馏实验装置。
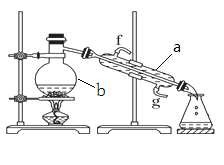
(1)写出仪器a的名称_______________。
(2)实验过程中,需要通冷水,图中的进水方向是______进(填图中字母f或g)。
(3)若利用该装置分离四氯化碳和酒精的混合物,还缺少的玻璃仪器是______。
(4)若用该装置制蒸馏水,实验时b中除加入少量自来水外,还需加入少量碎瓷片,其作用是_________________。
II.用98%的浓硫酸(其密度为1.84g/cm3)配制100mL 1.0mol·L-1稀硫酸,实验步骤如下:①计算所用浓硫酸的体积②量取一定体积的浓硫酸③稀释④检漏、转移、洗涤⑤定容、摇匀。若实验仪器有:A.100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶 E.10mL量筒 F.胶头滴管 G.50mL烧杯 H.100mL容量瓶。回答下列问题:
(1)需量取浓硫酸的体积为___________mL。
(2)实验时选用的仪器有___________(填序号)。
(3)配制过程中,下列情况会使配制结果偏高的是___________(填序号)。
①定容时俯视刻度线
②容量瓶使用时未干燥,残留少量蒸馏水
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
④用量筒量取浓硫酸时仰视读数
⑤在配制的过程中,将量取好的浓硫酸倒入烧杯中稀释,烧杯中的溶液未经冷却立即转移至容量瓶中,随即定容
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组在整理实验室化学试剂时,发现一瓶盛有无色溶液的试剂,标签破损,如图。
某同学根据中学化学知识,对该溶液中的溶质成分进行如下预测和验证,其中错误的是(包括预测物质的化学式、检验需要的试剂、操作、现象及结论)
选项 | 预测物质的化学式 | 检验需要的试剂 | 操作、现象及结论 |
A | Na2SO4 | 稀盐酸、氯化钡溶液 | 取少量该溶液于试管中,滴入稀盐酸,若无明显现象,再滴入氯化钡溶液,如果产生白色沉淀,则原溶液是Na2SO4溶液 |
B | Na2CO3 | 稀盐酸、澄清的石灰水 | 取少量该溶液于试管中,滴入足量稀盐酸,如果产生的无色气体能使澄清的石灰水变浑浊,则原溶液一定是Na2CO3溶液 |
C | Na2SO3 | 稀盐酸、澄清的石灰水、品红溶液 | 取少量该溶液于试管中,滴入足量稀盐酸,如果产生的无色气体既能使澄清的石灰水变浑浊,还能使品红溶液褪色,则原溶液是Na2SO3溶液 |
D | Na2SiO3 | 过量稀盐酸 | 取少量该溶液于试管中,滴入稀盐酸,产生白色胶状沉淀,盐酸过量时沉淀不溶解,则原溶液是Na2SiO3溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将V 1 mL 0.1mol·L-1的Fe2(SO4)3溶液与2mL 0.1mol·L-1KI溶液混合,待充分反应后,下列方法可证明该反应具有一定限度的是( )
A.若V1<1,加入淀粉B.若V1≤1,加入KSCN溶液
C.若V1≥1,加入AgNO3溶液D.加入Ba(NO3)2溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com