
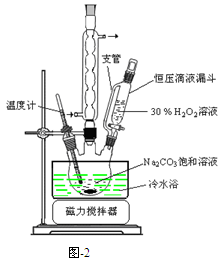
过碳酸钠(2Na2CO3·3H2O2)是一种集洗涤、漂白、杀菌于一体的氧系漂白剂,该晶体具有Na2CO3和H2O2的双重性质。利用图-2装置制备过碳酸钠,在冷水浴中充分反应后,按图-1流程可获得过碳酸钠产品。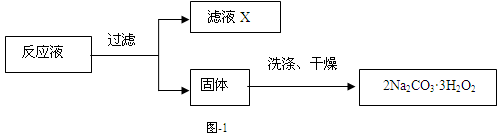
完成下列填空:
(1)恒压滴液漏斗中支管的作用是 。
(2)制备过碳酸钠的关键是 。
(3)不会使过碳酸钠失效的物质是_______(选填编号)。
a.Na2S b.CH3COOH c.NaHCO3
过碳酸钠产品中往往含有少量碳酸钠,可用重量法测定过碳酸钠的质量分数。
(4)完成实验步骤:
溶解 → 沉淀反应 → ________ → ________ → ________ → ________ 。
(5)写出沉淀反应的离子方程式________________________________________。
(6)需要直接测定的物理量有:________________________________(用字母表示并注明其含义)。产品中过碳酸钠质量分数的表达式为:________________。
(1)使液体顺利流下(1分)
(2)控制反应温度(1分)
(3)C(2分)
(4)过滤、洗涤、干燥、称量(0.5分×4)
(5)Ba2++ CO32-→ BaCO3↓(2分) 或其他正确答案,但必须与42的最后一空答案匹配。
(6)样品的质量m1g、沉淀的质量m2g (1分×2), 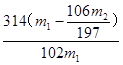 (2分)
(2分)
解析试题分析:(1)恒压滴液漏斗中支管连接了上下两端使液体上下气压相等,在重力作用下以漏斗中的液体能顺利流下。
(2)由于过氧化氢的稳定性受温度影响大,升温易分解,所以是控制好反应温度是关键。
(3)a.Na2S会和过氢化氢发生氧化还原反应, b.CH3COOH 会和碳酸钠发生反应,只有 c.NaHCO3不会使其变质。
(4)采用重量法最终要测定固体的质量,所以整个实验过程是:溶解 → 沉淀反应 →过滤→洗涤→干燥→称量。
(5)加入了钡离子,最终生成了碳酸钡沉淀,故反应方程为Ba2++ CO32-→ BaCO3↓
(6)要求出过碳酸钠质量分数,需要知道样品的质量m1g和由碳酸钠生成碳酸钡沉淀的质量m2g,这样通过碳元素守恒可得质量分数为: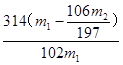
考点:考查了运用重量法测定样品组成的原理,同时又考查了离子方程式的书写和实验的操作过程。


科目:高中化学 来源: 题型:实验题
实验室中有一未知浓度的稀盐酸,某学生测定盐酸的浓度在实验室中进行实验。请完成填空:
(1)配制100 mL 0.10 mol/L NaOH标准溶液。
①主要操作步骤:计算→称量→溶解→(冷却后)转移→洗涤(并将洗涤液移入容量瓶)→ →将配制好的溶液倒入试剂瓶中,贴上标签。
②称量 g氢氧化钠固体所需仪器有:天平(带砝码、镊子)、 、 。
(2)取20.00 mL待测盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准液NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下:
| 实验编号 | NaOH溶液的浓度(mol/L) | 滴定完成时, NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积(mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
掌握仪器的名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。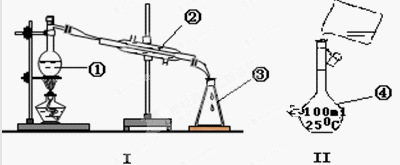
⑴写出下列仪器的名称:
①____________;②_____________;④__________;
⑵仪器①~④中,使用时必须检查是否漏水的有______。(填序号)
⑶若利用装置I分离四氯化碳和乙醇的混合物,还缺少的仪器是_________,将仪器补充完整后进行的实验操作的名称为_____________ 。现需配制250 mL 0.2 mol/L NaCl溶液,装置II是某同学转移溶液的示意图,图中的错误是______________、_________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
过氧化钙(CaO2)常用作种子消毒剂、药物制造、油脂漂白及高温氧化剂,还 可以作为鱼池增氧剂。査阅文献:过氧化钙的制备方法一般有两种方案。利用CaCl2在碱性条件下与H2O2反应或者利用Ca(OH)2的NH4Cl溶液与H2O2反应,均可得到CaO2·8H2O沉淀。已知CaO2·8H2O呈白色,微溶于水,在60℃下烘0.5小时可形成CaO2·2H2O,再在 140℃下烘0.5小时,得无水CaO2。加热至350℃左右开始分解放出氧气。
已知某化工厂生产过氧化钙的主要工艺流程如下: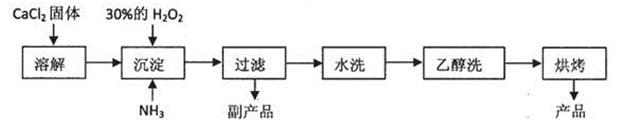
某化学实验小组在实验室中模拟上述流程制得产品并测定其中CaO2的含量。
(1)用上述方法制取CaO2·8H2O的化学方程式是: 。
(2)检验“水洗”是否合格的方法是: 。
(3)沉淀时常用冰水控制温度在0℃左右,其可能的原因分析:
①该反应是放热反应,温度低有利于提高CaO2·8H2O产率;
② 。
(4)测定产品中CaO2的含量的实验步骤是:
笫一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体, 再滴入少量2mol/L的硫酸溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol/L的Na2S2O3溶液至反应完全,滴定至终点,记录数据,再重复上述测定步骤一、二、三两次,得出三次平均消耗Na2S2O3溶液体枳为VmL
【已知:I2+2S2O32—=2I—+ S4O62—】
①上述第三步滴定至终点,现象为 。
②CaO2的质量分数为 (用字母表示)
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某学习小组的三位同学为测定镀锌铁皮的镀层的厚度,提出了各自的设计方案。(忽略锌镀层的氧化)甲同学的方案:先用盐酸将镀锌铁皮表面的锌反应掉,通过差量计算出锌的质量,然后再由锌的密度算出锌层的体积,最后由体积除以镀锌铁皮的面积计算得到锌层的厚度。
(1)甲同学的方案是否可行,说出理由: 。
乙同学的方案:通过查阅资料,知道Zn(OH)2既可以与酸也可与碱反应,于是设计了如下方案:
(2)配制5%的盐酸1 L (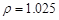 g/cm3 ),需取用36.5% (
g/cm3 ),需取用36.5% (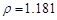 g/cm3 )的盐酸 mL
g/cm3 )的盐酸 mL
(保留一位小数)。
(3)若使用的镀锌铁皮的质量为28.357g,最后称得灼烧后固体的质量为40.000g,镀锌铁皮的长5.00cm,宽5.00cm,锌的密度为7.14g/cm3,则锌层的厚度为 cm。丙同学的方案:通过如图所示装置,测量镀锌铁皮与稀H2SO4反应产生气体的质量来计算锌层的厚度。己称得镀锌铁皮质量为18.200g。
(4)实验所用称量仪器为 。
(5)若改用浓盐酸,则测出锌的厚度会 (填“偏大”、“偏小”、或“无影响”)。
(6)实验后,将乙同学和丙同学的结果进行比较,发现他们对同种镀锌铁皮的测量结果差异很大,你认为谁的方案更加可靠呢? 理由是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
向溴水中加入足量乙醛溶液,可以看到溴水褪色。据此对溴水与乙醛发生的有机反应类型进行如下探究,请你完成下列填空:
I.猜测:
(1)溴水与乙醛发生取代反应;
(2)溴水与乙醛发生加成反应;
(3)溴水与乙醛发生_______反应。
II.设计方案并论证:
为探究哪一种猜测正确,某研究性学习小组提出了如下两种实验方案:
方案l:检验褪色后溶液的酸碱性。
方案2:测定反应前用于溴水制备的Br2的物质的量和反应后Br-离子的物质的量。
(1)方案1是否可行? _______,理由是__________________________________________
(2)假设测得反应前用于溴水制备的Br2的物质的量为a mol 。
若测得反应后n(Br-) = _______mol,则说明溴水与乙醛发生加成反应;;
若测得反应后n(Br-) = _______mol,则说明溴水与乙醛发生取代反应;
若测得反应后n(Br-) = _______mol,则说明猜测(3)正确。
III.实验验证:某同学在含0.005molBr2的10mL溶液中,加入足量乙醛溶液使其褪色;再加入过量AgNO3溶液,得到淡黄色沉淀l.88 g(已知反应生成有机物与AgNO3不反应)。根据计算结果,推知溴水与乙醛反应的离子方程式为__________________________________________。
IV.拓展
请你设计对照实验,探究乙醛和乙醇的还原性强弱(填写下表)。
| 实验操作步骤 | 实验现象 | 结论 |
| | | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
CuSO4·5H2O是铜的重要化合物,有着广泛的应用。实验室用粗铜(含少量铁)制备CuSO4·5H2O的流程如下:
回答下列问题:
(1)实验室配制250 mL4.8 mol·L-1的稀硫酸,所需的玻璃仪器除玻璃棒、量筒、烧杯以外还需要__________________________________________________。
(2)已知不同金属离子生成氢氧化物沉淀所需的pH如下表:
| 离子 | Fe3+ | Cu2+ | Fe2+ |
| 开始沉淀的pH | 2.7 | 4.4 | 7.0 |
| 沉淀完全的pH | 3.7 | 6.4 | 9.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列实验方案设计中,可行的是( )
| A.加稀盐酸后过滤,除去混在铜粉中的少量镁粉和铝粉 |
| B.用萃取的方法分离汽油和煤油 |
| C.用溶解、过滤的方法分离硝酸钾和氯化钠固体的混合物 |
| D.将氢气和氧气的混合气体通过灼热的氧化铜,以除去其中的氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干 燥后,沉淀质量为2.33g。根据上述实验,以下推测正确的是
| A.Cl-不可能存在 | B.100mL溶液中含0.01mol CO32- |
| C.K+一定存在 | D.Ba2+一定不存在,Mg2+可能存在 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com