
【题目】我们要持之以恒,建设天蓝、地绿、水清的中国.水处理技术在生活、生产中应用广泛,对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施.
(1)①生活用水必须保证安全,自来水厂需要对取自江河湖泊中的淡水进行a.杀毒灭菌,b.混凝沉淀,c.过滤等工艺处理,这三项处理的正确顺序是(填字母)
②工业上常用硫酸亚铁作混凝剂除去天然水中含有的悬浮物和胶体,为了达到更好的效果,要将待处理水的pH值调到9左右,再加入绿矾.请解释这一做法的原因:(用必要的离子方程式和文字描述);
③下列试剂能够用来对自来水进行杀菌消毒,且不会造成二次污染的是(填字母)
a.福尔马林 b.漂白粉 c.氯气 d.臭氧
④石灰纯碱法是常用的硬水软化方法.已知25℃时Ksp=2.8×10﹣9 , 现将等体积的Ca(OH)2溶液与Na2CO3溶液混合(假设溶液体积具有加和性),若Na2CO3溶液的浓度为.6×10﹣5molL﹣1 , 则生成沉淀所需Ca(OH)2溶液的最小浓度为 .
(2)金属铬污染环境,其主要来源于冶金、水泥等工业产生的废水.某兴趣小组拟定以下流程,对Cr3+、Fe2+等离子的废水进行无公害处理 
请回答下列问题
①写出加入双氧水后发生反应的离子方程式:;
②过滤操作需要的玻璃仪器是;
③活性炭的作用是 .
【答案】
(1)bca;Fe2+在碱性条件下易被氧化成Fe3+ , 进而水解生成Fe(OH)3胶体,起到较好的混凝作用,4Fe2++O2+2H2O+8OH﹣=4Fe(OH)2(胶体);d;2.0×10﹣4mol?L﹣1
(2)2Fe2++H2O2+2H+=2Fe3++2H2O;烧杯、漏斗、玻璃棒;吸附溶液在水中的杂质,并除去水中的异味
【解析】解:(1)①生活用水必须保证安全,自来水厂需要对取自江河湖泊中的淡水进行杀菌消毒、混凝沉淀、过滤等工艺处理,这三项处理的正确顺序是混凝沉淀→过滤→杀菌消毒,所以答案是:bca;②工业上常用硫酸亚铁作混凝剂除去天然水中含有的悬浮物和胶体,为了达到更好的效果,要将待处理水的pH调到9左右,再加绿矾,原因:Fe2+在碱性条件下易被氧化成Fe3+ , 进而水解生成Fe(OH)3胶体,起到较好的混凝作用,4Fe2++O2+2H2O+8OH﹣=4Fe(OH)3(胶体),所以答案是:Fe2+在碱性条件下易被氧化成Fe3+ , 进而水解生成Fe(OH)3胶体,起到较好的混凝作用,4Fe2++O2+2H2O+8OH﹣=4Fe(OH)2(胶体);③福尔马林有毒,含氯物质可导致二次污染,则能够用来对自来水进行杀菌消毒,且不会造成二次污染的只有臭氧,所以答案是:d;④Na2CO3溶液的浓度为5.6×10﹣5mol/L,等体积混合后溶液中c(CO32﹣)= ![]() ×5.6×10﹣5mol/L=2.8×10﹣5mol/L,根据Ksp=c(CO32﹣)c(Ca2+)=2.8×10﹣9可知,c(Ca2+)=
×5.6×10﹣5mol/L=2.8×10﹣5mol/L,根据Ksp=c(CO32﹣)c(Ca2+)=2.8×10﹣9可知,c(Ca2+)= ![]() mol/L=1×10﹣4mol/L,原溶液Ca(OH)2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液Ca(OH)2溶液的最小浓度为2×1×10﹣4mol/L=2×10﹣4mol/L,所以答案是:2.0×10﹣4molL﹣1;(2)含Cr3+、Fe2+、Ca2+等离子的废水加入过氧化氢,可氧化Fe2+生成Fe3+ , 然后加入NaOH溶液调节pH=8可除去Cr3+、Fe3+ , 过滤后滤液用钠离子交换树脂除去Ca2+ , 最后用活性炭吸附溶解在水中的杂质,并除去水中的异味,可得用于日常生活的净化水,①过氧化氢可氧化Fe2+生成Fe3+ , 反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,所以答案是:2Fe2++H2O2+2H+=2Fe3++2H2O;②过滤常用到的玻璃仪器有烧杯、漏斗、玻璃棒,所以答案是:烧杯、漏斗、玻璃棒;③活性炭具有吸附作用,可吸附溶解在水中的杂质,并除去水中的异味,所以答案是:吸附溶液在水中的杂质,并除去水中的异味.
mol/L=1×10﹣4mol/L,原溶液Ca(OH)2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液Ca(OH)2溶液的最小浓度为2×1×10﹣4mol/L=2×10﹣4mol/L,所以答案是:2.0×10﹣4molL﹣1;(2)含Cr3+、Fe2+、Ca2+等离子的废水加入过氧化氢,可氧化Fe2+生成Fe3+ , 然后加入NaOH溶液调节pH=8可除去Cr3+、Fe3+ , 过滤后滤液用钠离子交换树脂除去Ca2+ , 最后用活性炭吸附溶解在水中的杂质,并除去水中的异味,可得用于日常生活的净化水,①过氧化氢可氧化Fe2+生成Fe3+ , 反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,所以答案是:2Fe2++H2O2+2H+=2Fe3++2H2O;②过滤常用到的玻璃仪器有烧杯、漏斗、玻璃棒,所以答案是:烧杯、漏斗、玻璃棒;③活性炭具有吸附作用,可吸附溶解在水中的杂质,并除去水中的异味,所以答案是:吸附溶液在水中的杂质,并除去水中的异味.


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:
【题目】氮族元素化合物在医药、纳米材料制备中应用广泛.
(1)P元素的基态电子电子排布式为
(2)白磷的分子式为P4 , 其结构如图1所示,科学家目前合成了 N4分子,N 原子的杂化轨道类型是 , N﹣N﹣N 键的键角为; 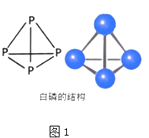
(3)N、P、As原子的第一电离能由大到小的顺序为 .
(4)HNO3、HNO2是氮元素形成的含氧酸,酸性较强的是 , 酸根中没有孤对电子的是 , NO2﹣价电子构型是 .
(5)立方氮化硼晶体的结构如图2所示:N与As是同族元素,B与Ga是同族元素,立方砷化镓晶体与立方氮化硼晶体结构类似,两种晶体中熔点较高的是;立方砷化镓晶体的晶胞边长为a pm,则其密度为gcm﹣3(用含a的式子表示,设NA为阿伏伽德罗常数的值). 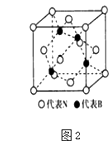
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 利用溶液和胶体中分散质粒子大小不同,用滤纸来分离溶液和胶体
B. 有化学键断裂或化学键形成的过程都是化学变化
C. 焰色反应属于吸热反应
D. 食盐溶液能导电,但食盐溶液不是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】手持技术是基于数据采集器、传感器和多媒体计算机构成的一种新兴掌上试验系统,具有实时、定量、直观等特点,下图是利用手持技术得到的微粒物质的量变化图,常温下向20mL0.2mol/LH2A溶液中滴加0.2mol/LNaOH溶液.下列说法正确的是( ) 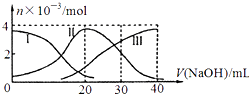
A.H2 A在水中的电离方程式是:H2A=H ++HA ﹣;HA ﹣═H++A2﹣
B.当V(NaOH)=20mL时,则有:c(Na + )>c(HA﹣ )>c(H + )>c(A 2﹣ )>c(OH﹣ )
C.当V(NaOH)=30mL时,则有:2c(H + )+c(HA﹣ )+2c(H2A)=c(A 2﹣ )+2 c(OH﹣ )
D.当V(NaOH)=40mL时,其溶液中水的电离受到抑制
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素X 的最高价含氧酸的化学式为 HnXO2n-2,则在某气态氢化物中,X 元素的化合价为:
A. 5n-12B. 3n-12C. 3n-6D. n-10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA代表阿伏伽德罗常数,下列说法正确的是( )
A.相同质量的铝,分别与足量的盐酸和氢氧化钠溶液反应放出的氢气体积一定不相同
B.56gFe与足量盐酸反应转移电子数为3NA
C.任何条件下,22.4LNH3与18gH2O所含电子数均为10NA
D.46gNO2和N2O4的混合物含有的原子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列装置进行相应实脸,不能达到实验目的是( )
A. 如图装置可用于制备氢氧化亚铁
如图装置可用于制备氢氧化亚铁
B. 如图装置可用于测定Na2CO3和NaHCO3混合物中NaHCO3的含量
如图装置可用于测定Na2CO3和NaHCO3混合物中NaHCO3的含量
C. 如图装置可用于检验氨气溶于水后显碱性
如图装置可用于检验氨气溶于水后显碱性
D. 如图装置可用于CaCO3和稀盐酸反应制取少量的CO2气体
如图装置可用于CaCO3和稀盐酸反应制取少量的CO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图象能表示相关反应中生成物物质的量的变化的是(横、纵坐标单位:mol)( )
A. n (HCl)=1mol,K2CO3加入到HCl溶液中,在敝口容器中生成的气体
n (HCl)=1mol,K2CO3加入到HCl溶液中,在敝口容器中生成的气体
B. n(NaOH)=1mol,CO2通入到NaOH溶液中反应生成的盐
n(NaOH)=1mol,CO2通入到NaOH溶液中反应生成的盐
C. n(NaAlO2)=1mol,HCl加入到NaAlO2溶液中离子的存在情况
n(NaAlO2)=1mol,HCl加入到NaAlO2溶液中离子的存在情况
D. n(AlCl3)=1mol,Na2O2加入AlCl3溶液反应的产物
n(AlCl3)=1mol,Na2O2加入AlCl3溶液反应的产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组研究铝土矿中Al2O3的含量.查阅资料得知,铝土矿的主要成分是Al2O3 , 杂质是Fe2O3、SiO2等.从铝土矿中提取Al2O3的过程如下: 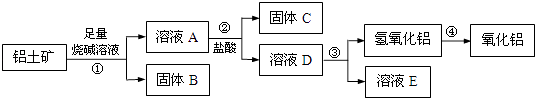
(1)固体B的主要用途有(写出1条即可): .
(2)第①步,向铝土矿中加入足量烧碱溶液后,发生反应的离子方程式是: ;;
第③步中,生成氢氧化铝的化学方程式是: .
(3)将实验过程中所得固体精确称量,课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,则该铝土矿中Al2O3的质量分数是: . (保留一位小数)
(4)工业上制取AlCl3用Al2O3与C、Cl2在高温条件下反应,每消耗0.5mol 碳单质,转移1mol电子,反应的化学方程式是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com