
【题目】某课外小组研究铝土矿中Al2O3的含量.查阅资料得知,铝土矿的主要成分是Al2O3 , 杂质是Fe2O3、SiO2等.从铝土矿中提取Al2O3的过程如下: 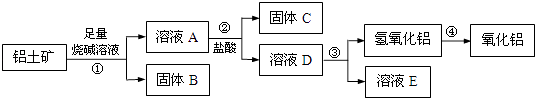
(1)固体B的主要用途有(写出1条即可): .
(2)第①步,向铝土矿中加入足量烧碱溶液后,发生反应的离子方程式是: ;;
第③步中,生成氢氧化铝的化学方程式是: .
(3)将实验过程中所得固体精确称量,课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,则该铝土矿中Al2O3的质量分数是: . (保留一位小数)
(4)工业上制取AlCl3用Al2O3与C、Cl2在高温条件下反应,每消耗0.5mol 碳单质,转移1mol电子,反应的化学方程式是 .
【答案】
(1)炼铁原料、用作涂料、油漆等
(2)Al2O3+2OH﹣=2AlO2﹣+H2O; SiO2+2OH﹣=SiO32﹣+H2O; AlCl3+3NH3?H2O=Al(OH)3↓+3NH4Cl
(3)65.4%
(4)Al2O3+3Cl2+3C ![]() 2AlCl3+3CO
2AlCl3+3CO
【解析】解:(1)向铝土矿中加入足量烧碱溶液后,则在①得到滤液中含有偏铝酸根离子、硅酸根离子,滤渣为氧化铁,氧化铁可作为炼铁的原料,氧化铁为红色,可用作涂料、油漆等,
故答案为:炼铁原料、用作涂料、油漆等;(2)根据框图流程,向铝土矿中加入足量烧碱溶液后,氧化铝是两性氧化物,既溶液强酸又溶于强碱.只Fe2O3溶于强酸,不溶于碱,SiO2只溶于强碱,不溶于酸,则在①得到滤液中含有偏铝酸根离子、硅酸根离子,滤渣为氧化铁氧化铁和氢氧化钠溶液不反应,
则向铝土矿中加入足量烧碱溶液后,发生反应的离子方程式是Al2O3+2OH﹣=2AlO2﹣+H2O、SiO2+2OH﹣=SiO32﹣+H2O,固体B是氧化铁,A中含有偏铝酸钠和硅酸钠以及过量的氢氧化钠,则加入过量的盐酸后生成硅酸沉淀和氯化铝,发生反应的离子方程式是SiO2+2OH﹣=SiO32﹣+H2O,即固体C是硅酸,D中含有氯化铝和盐酸,因此反应③中生成氢氧化铝的试剂是氨气或氨水,则生成氢氧化铝的方程式是AlCl3+3NH3H2O=Al(OH)3↓+3NH4Cl,
故答案为:Al2O3+2OH﹣=2AlO2﹣+H2O;SiO2+2OH﹣=SiO32﹣+H2O;AlCl3+3NH3H2O=Al(OH)3↓+3NH4Cl;(3)将实验过程中所得固体精确称量,课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,说明所得氢氧化铝固体的质量与原铝土矿质量相等,即铝土矿中Al2O3的质量分数和氢氧化铝中氧化铝的质量分数是相同的.又因为氧化铝可以写成Al2O33H2O的形式,所以质量分数是 ![]() ×100%=65.4%,
×100%=65.4%,
故答案为:65.4%;(4)Cl2有强氧化性,碳具有还原性,每消耗0.5 mol 碳单质,转移1mol电子,这说明反应中碳失去2个电子,即氧化产物是CO,所以反应的化学方程式是Al2O3+3Cl2+3C ![]() 2AlCl3+3CO,
2AlCl3+3CO,
故答案为:Al2O3+3Cl2+3C ![]() 2AlCl3+3CO;
2AlCl3+3CO;
(1)氧化铁为红色,简称铁红,可用作涂料、油漆等;(2)向铝土矿中加入足量烧碱溶液后,氧化铝是两性氧化物,既溶液强酸又溶于强碱.只Fe2O3溶于强酸,不溶于碱,SiO2只溶于强碱,不溶于酸,则在①得到滤液中含有偏铝酸根离子、硅酸根离子,滤渣为氧化铁.②为盐酸,除去硅酸根离子,将偏铝酸根离子转化为铝离子,进入②得到滤液.试剂③为氨水,将铝离子转化为氢氧化铝沉淀.加热分解得氧化铝;(3)所得氢氧化铝固体的质量与原铝土矿质量相等,这说明铝土矿中Al2O3的质量分数和氢氧化铝中氧化铝的质量分数是相同;(4)Cl2有强氧化性,将C氧化为CO,自身被还原为C1﹣,根据得失电子守恒解答;


科目:高中化学 来源: 题型:
【题目】我们要持之以恒,建设天蓝、地绿、水清的中国.水处理技术在生活、生产中应用广泛,对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施.
(1)①生活用水必须保证安全,自来水厂需要对取自江河湖泊中的淡水进行a.杀毒灭菌,b.混凝沉淀,c.过滤等工艺处理,这三项处理的正确顺序是(填字母)
②工业上常用硫酸亚铁作混凝剂除去天然水中含有的悬浮物和胶体,为了达到更好的效果,要将待处理水的pH值调到9左右,再加入绿矾.请解释这一做法的原因:(用必要的离子方程式和文字描述);
③下列试剂能够用来对自来水进行杀菌消毒,且不会造成二次污染的是(填字母)
a.福尔马林 b.漂白粉 c.氯气 d.臭氧
④石灰纯碱法是常用的硬水软化方法.已知25℃时Ksp=2.8×10﹣9 , 现将等体积的Ca(OH)2溶液与Na2CO3溶液混合(假设溶液体积具有加和性),若Na2CO3溶液的浓度为.6×10﹣5molL﹣1 , 则生成沉淀所需Ca(OH)2溶液的最小浓度为 .
(2)金属铬污染环境,其主要来源于冶金、水泥等工业产生的废水.某兴趣小组拟定以下流程,对Cr3+、Fe2+等离子的废水进行无公害处理 
请回答下列问题
①写出加入双氧水后发生反应的离子方程式:;
②过滤操作需要的玻璃仪器是;
③活性炭的作用是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求回答问题:
(1)向某NaOH溶液中投入一块Al箔,先无明显现象,随后逐渐产生气泡,则产生气泡的离子反应方程式为 .
(2)实验室常用还原性Fe粉与水蒸气反应的实验来研究Fe的还原性,则该反应的化学反应方程式为 .
(3)Fe(OH)2制备时,采用的方法是“长滴管、液面下”的实验操作,但在实验时,由于操作不当,依旧会出现白色沉淀、灰绿色沉淀直至最终变为红褐色沉淀,写出白色沉淀最终转化为红褐色沉淀的化学反应方程式为 .
(4)实验时制备Al(OH)3时,常用可溶性铝盐(如Al2(SO4)3与氨水反应进行制备.某课外小组在实验时不慎向Al2(SO4)3溶液中加入了过量NaOH溶液,最终并没有制出白色沉淀Al(OH)3 , 则该小组同学实验时发生的总离子反应方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列鉴别方法不可行的是
A. 用水鉴别乙醇、甲苯 B. 用燃烧法鉴别乙醇、苯
C. 用碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯 D. 用酸性高锰酸钾溶液鉴别苯、环已烯和环已烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将50g质量分数为ω1 , 物质的量浓度为C1的浓硫酸沿玻璃棒加入到VmL水中,稀释后得到质量分数为ω2 , 物质的量浓度为C2的稀溶液.下列说法中正确的是( )
A.若C1=2C2 , 则ω1<2ω2 , V<50mL
B.若C1=2C2 , 则ω1<2ω2 , V>50mL
C.若ω1=2ω2 , 则C1<2C2 , V=50mL
D.若ω1=2ω2 , 则C1>2C2 , V<50Ml
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,水的离子积常数KW=1×10﹣12 . 该温度下,将pH=4的H2SO4溶液与pH=9的NaOH溶液混合并保持恒温,欲使混合溶液的pH=7,则稀硫酸与NaOH溶液的体积比为( )
A.1:10
B.9:1
C.1:9
D.99:21
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B两种烃,已知A的分子式为C5Hm , 而B的最简式为C5Hn(m、n均为正整数).请回答下列问题:
(1)下列关于烃A和烃B的说法不正确的是(填序号).
a.烃A和烃B可能互为同系物
b.烃A和烃B可能互为同分异构体
c.当m=12时,烃A一定为烷烃
d.当n=11时,烃B可能的分子式有2种
(2)若烃A为链烃,且分子中所有碳原子都在同一条直线上,则A的结构简式为
(3)若烃A为链烃,且分子中所有碳原子一定共面,在一定条件下,1mol A最多可与1mol H2加成,则A的名称是 .
(4)若烃B为苯的同系物,取一定量的烃B完全燃烧后,生成物先通过足量的浓硫酸,浓硫酸的质量增加1.26g,再通过足量的碱石灰,碱石灰的质量增加4.4g,则烃B的分子式为;若其苯环上的一溴代物只有一种,则符合此条件的烃B有种.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题
(1)从鸡蛋白的溶液中提取鸡蛋白的方法有和。
(2)鸡蛋腐败时会放出有刺激性气味的气体,该气体主要是 , 说明蛋白质中含有元素。
(3)误食重金属盐会中毒,这是因为。
(4)浓硝酸溅在皮肤上,使皮肤呈现色,这是浓硝酸和蛋白质发生了反应的缘故。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com