
【题目】手持技术是基于数据采集器、传感器和多媒体计算机构成的一种新兴掌上试验系统,具有实时、定量、直观等特点,下图是利用手持技术得到的微粒物质的量变化图,常温下向20mL0.2mol/LH2A溶液中滴加0.2mol/LNaOH溶液.下列说法正确的是( ) 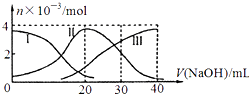
A.H2 A在水中的电离方程式是:H2A=H ++HA ﹣;HA ﹣═H++A2﹣
B.当V(NaOH)=20mL时,则有:c(Na + )>c(HA﹣ )>c(H + )>c(A 2﹣ )>c(OH﹣ )
C.当V(NaOH)=30mL时,则有:2c(H + )+c(HA﹣ )+2c(H2A)=c(A 2﹣ )+2 c(OH﹣ )
D.当V(NaOH)=40mL时,其溶液中水的电离受到抑制
【答案】B
【解析】解:A.根据图知,溶液中存在HA﹣、H2A、A2﹣ , 说明该酸是二元弱酸,在水溶液中部分电离,所以其二元酸的电离方程式为H2AH ++HA ﹣;HA﹣H++A2﹣ , 故A错误;B.当V(NaOH)=20mL时,二者恰好完全反应生成NaHA,溶液中存在HA﹣、H2A、A2﹣ , 说明HA﹣ 能电离和水解,且c(H2A)<c(A 2﹣ ),说明其电离程度大于水解程度,导致溶液呈酸性,其电离和水解程度都较小,则溶液中离子浓度大小顺序是:c(Na + )>c(HA﹣ )>c(H + )>c(A 2﹣ )>c(OH﹣ ),故B正确;
C.当V(NaOH)=30mL时,发生反应为NaOH+H2A=NaHA+H2O,NaHA+NaOH=Na2A+H2O,溶液主要为等物质量的NaHA,Na2A的混合溶液,根据电荷守恒得:c(Na+)+c(H+)=c(HA﹣)+2c(A2﹣)+c(OH﹣)①,物料守恒可知:3c(HA﹣)+3c(A2﹣)+3c(H2A)=2c(Na+)②,①×2+②得:2c(H+)+c(HA﹣)+3c(H2A)═c(A2﹣)+2c(OH﹣),故C错误;
D.当V(NaOH)=40mL时,二者恰好完全反应生成强碱弱酸盐Na2A,含有弱离子的盐促进水电离,所以Na2A促进水电离,故D错误;
故选B.


科目:高中化学 来源: 题型:
【题目】碱式氯化铝[Al2(OH)nCl6﹣n]是利用工业铝灰和活性铝矾土为原料(主要含Al、Al2O3、SiO2及铁的氧化物)经过精制加工而成,此产品活性较高,对工业污水具有较好的净化效果.其制备流程如下: 
(1)原料需要粉碎,其目的是;滤渣I的主要成分是;
(2)步骤①在煮沸过程中,溶液逐渐变为浅绿色,检验溶液中呈浅绿色的阳离子常采用加入溶液进行检验(填试剂化学式).
(3)步骤②中加入适量的Ca(OH)2并控制pH,其目的:一是生成碱式氯化铝;二是;已知碱式氯化铝的分散质粒子大小在1~100nm之间,则区别滤液I与碱式氯化铝两种液体的物理方法是;若Ca(OH)2溶液过量,则步骤③得到的碱式氯化铝产率偏低,用离子方程式解释其原因为;
(4)某温度下若0.1mol AlCl3溶于蒸馏水,当有2.5%水解生成Al(OH)3胶体时,吸收热量Q kJ,该水解过程的热化学反应方程为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属的腐蚀与防护的说法正确的是( )
A. 金属发生吸氧腐蚀时,被腐蚀的速率与氧气浓度无关
B. 验证铁的吸氧腐蚀,可以将铁钉放入试管中,用盐酸浸没
C. 钢铁水闸可用牺牲阳极或外加电流的阴极保护法防止其腐蚀
D. 钢铁发生析氢腐蚀时,负极反应Fe-3e-= Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质,以C4H10为燃料时,该电池工作原理如图.下列说法正确的是( ) 
A.a为C4H10 , b为CO2
B.在熔融电解质中,CO32﹣向正极移动
C.此电池在常温时也能工作
D.通入丁烷的一极是负极,电极反应为:C4H10﹣26e﹣+13CO32﹣=17CO2↑+5H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种芳香族化合物都是某些植物挥发油中的主要成分,有的是药物,有的是香料.它们的结构简式如下所示: 
(1)B中的含氧官能团名称是
(2)B与足量氢气充分反应的产物的结构简式为 .
(3)D发生聚合反应的产物的结构简式为 .
(4)A能与乙醇发生反应生成一种有特殊香味的物质,请写出该反应的方程式:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我们要持之以恒,建设天蓝、地绿、水清的中国.水处理技术在生活、生产中应用广泛,对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施.
(1)①生活用水必须保证安全,自来水厂需要对取自江河湖泊中的淡水进行a.杀毒灭菌,b.混凝沉淀,c.过滤等工艺处理,这三项处理的正确顺序是(填字母)
②工业上常用硫酸亚铁作混凝剂除去天然水中含有的悬浮物和胶体,为了达到更好的效果,要将待处理水的pH值调到9左右,再加入绿矾.请解释这一做法的原因:(用必要的离子方程式和文字描述);
③下列试剂能够用来对自来水进行杀菌消毒,且不会造成二次污染的是(填字母)
a.福尔马林 b.漂白粉 c.氯气 d.臭氧
④石灰纯碱法是常用的硬水软化方法.已知25℃时Ksp=2.8×10﹣9 , 现将等体积的Ca(OH)2溶液与Na2CO3溶液混合(假设溶液体积具有加和性),若Na2CO3溶液的浓度为.6×10﹣5molL﹣1 , 则生成沉淀所需Ca(OH)2溶液的最小浓度为 .
(2)金属铬污染环境,其主要来源于冶金、水泥等工业产生的废水.某兴趣小组拟定以下流程,对Cr3+、Fe2+等离子的废水进行无公害处理 
请回答下列问题
①写出加入双氧水后发生反应的离子方程式:;
②过滤操作需要的玻璃仪器是;
③活性炭的作用是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据氢原子和氟原子的核外电子排布,对F2和HF分子中形成的共价键描述正确的是( )
A. 两者都为s-s σ键
B. 两者都为p-p σ键
C. 前者为p-p σ键,后者为s-p σ键
D. 前者为s-s σ键,后者为s-p σ键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求回答问题:
(1)向某NaOH溶液中投入一块Al箔,先无明显现象,随后逐渐产生气泡,则产生气泡的离子反应方程式为 .
(2)实验室常用还原性Fe粉与水蒸气反应的实验来研究Fe的还原性,则该反应的化学反应方程式为 .
(3)Fe(OH)2制备时,采用的方法是“长滴管、液面下”的实验操作,但在实验时,由于操作不当,依旧会出现白色沉淀、灰绿色沉淀直至最终变为红褐色沉淀,写出白色沉淀最终转化为红褐色沉淀的化学反应方程式为 .
(4)实验时制备Al(OH)3时,常用可溶性铝盐(如Al2(SO4)3与氨水反应进行制备.某课外小组在实验时不慎向Al2(SO4)3溶液中加入了过量NaOH溶液,最终并没有制出白色沉淀Al(OH)3 , 则该小组同学实验时发生的总离子反应方程式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com