
| A.称量样品→加热→冷却→称量CuO |
| B.称量样品→加热→冷却→称量Cu(NO3)2 |
| C.称量样品→加NaOH→过滤→加热→冷却→称量CuO |
| D.称量样品→加热→用已知质量的无水氯化钙吸收水蒸气并称量 |
科目:高中化学 来源:不详 题型:实验题
[规格]每片含琥珀酸亚铁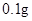 [适应症]用于缺铁性贫血症,预防及治疗用。 [用量用法]成人预防量 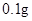 /日,成人治疗量 /日,成人治疗量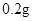 — —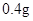 /日。 /日。小儿用量预防量 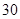 — —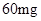 /日,治疗量 /日,治疗量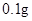 — —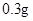 /日 /日[贮藏]避光、密封、在干燥处保存。 |
查看答案和解析>>
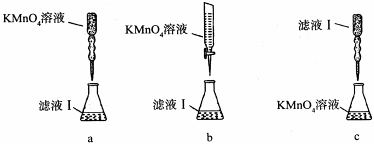
科目:高中化学 来源:不详 题型:实验题
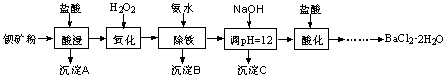

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.清洗做完焰色反应的铂丝——稀盐酸 |
| B.干燥CO气体——浓硫酸 |
| C.洗去附着在试管内壁的硫——热NaOH溶液 |
| D.洗去附着在试管内壁的氯化银——稀硝酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 12Na2CrO4+3Fe2O3+7KCl+12H2O。
12Na2CrO4+3Fe2O3+7KCl+12H2O。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.准确称取0.40g的NaOH固体配成1000mL浓度为0.01000mol·L-1的NaOH溶液 |
| B.将铜与足量的浓硝酸反应生成的气体干燥后收集,用冰水混合物冷却降温,以此研究温度对化学平衡的影响 |
| C.将滴有稀硫酸的淀粉溶液加热后,加入新制的Cu(OH)2悬浊液,加热,没有红色沉淀,说明淀粉在该条件下没有水解。 |
| D.过滤时用玻璃棒搅拌漏斗中的液体,以加快过滤速度 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

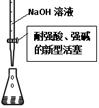
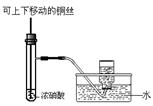
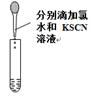
| A.用①量取15.00 mL NaOH溶液 |
| B.用②制备并收集少量NO2气体 |
| C.用③所示的仪器配制1L 0.1000mol/LNaCl溶液 |
| D.用④进行Fe2+的检验 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
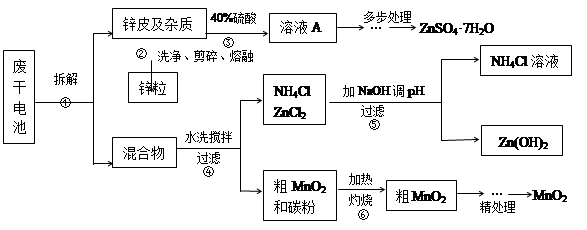
| NH3·H2O的Kb | Zn2+完全沉淀的pH | Zn(OH)2溶于碱的pH |
| 1.8×10-5 | 8.9 | >11 |
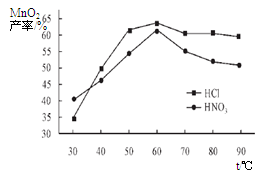
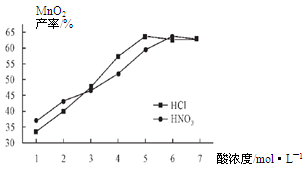
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
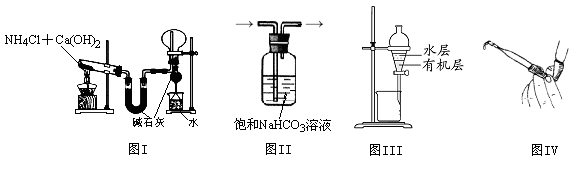
| A.图I用于实验室制氨气并收集干燥的氨气 | B.图II用于除去CO2中含有的少量HCl |
| C.图III用于提取I2的CCl4溶液中的I2 | D.图IV用于检查碱式滴定管是否漏液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com