
【题目】在25℃时,甘氨酸在水溶液中解离情况如下:H3N+CH2COOH(A+)![]() H3N+CH2COO-(A±)
H3N+CH2COO-(A±)![]() H2NCH2COO-(A-),改变溶液pH值,三种甘氨酸相关离子的分布分数(α,平衡时某物种的浓度占各物种浓度之和的分数)变化如图所示。当调节溶液的pH值使甘氨酸所带的净电荷为零,此时溶液的pH叫等电点。下列说法正确的是( )
H2NCH2COO-(A-),改变溶液pH值,三种甘氨酸相关离子的分布分数(α,平衡时某物种的浓度占各物种浓度之和的分数)变化如图所示。当调节溶液的pH值使甘氨酸所带的净电荷为零,此时溶液的pH叫等电点。下列说法正确的是( )
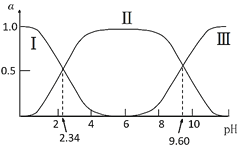
A.曲线Ⅰ、Ⅱ、Ⅲ分别代表的微粒为A、A±、A+
B.K2=102.34,且K2对应的解离基团为-NH3+
C.在pH=9.60的溶液中加盐酸,α(A±)+α(A+)+α(A)保持不变
D.甘氨酸的等电点pH约为6,且存在c(A±)=c(A+)=c(A)
【答案】C
【解析】
A.根据其解离情况可知:溶液碱性越强,A-含量越大,溶液酸性越强,A+含量越大,故曲线Ⅰ、Ⅱ、Ⅲ分别代表的微粒为A+、A±、A-,A错误;
B.由图可知pH=9.60时,溶液中H3N+CH2COO-与H2NCH2COO-浓度相等,K2对应的解离过程为:H3N+CH2COO-![]() H2NCH2COO-+H+,K2=
H2NCH2COO-+H+,K2=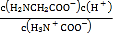 =10-9.60,K2对应的解离基团为COO-,B错误;
=10-9.60,K2对应的解离基团为COO-,B错误;
C.根据物料守恒可知,α(A±)+α(A+)+α(A-)保持不变,C正确;
D.由图可知,等电点pH约为6,此时溶液中c(H3N+CH2COO-)>c(H3N+CH2COOH)=c(H2NCH2COO-),D错误;
故合理选项是C。


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】在含有Ag+的酸性溶液中,以铁铵矾NH4Fe(SO4)2作指示剂,用KSCN的标准溶液滴定Ag+.已知:AgSCN(白色s)![]() Ag++SCN-,Ksp=1.0×10-12;Fe3++SCN-
Ag++SCN-,Ksp=1.0×10-12;Fe3++SCN-![]() [Fe(SCN)] 2+(红色),K=138。下列说法不正确的是( )
[Fe(SCN)] 2+(红色),K=138。下列说法不正确的是( )
A. 边滴定,边摇动溶液,溶液中首先析出AgSCN白色沉淀
B. 当Ag+定量沉淀后,少许过量的SCN-与Fe3+生成红色配合物,即为终点
C. 上述实验可用KCl标准溶液代替KSCN的标准溶液滴定Ag+
D. 滴定时,必须控制溶液一定的酸性,防止Fe3+水解,影响终点的观察
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,HNO2的电离常数Ka=7.1×10-4,NH3·H2O的电离常数Kb=1.7×10-5。0.1 mol·L-1 NH4NO2溶液中,离子浓度由大到小的顺序是__________,常温下NO2-水解反应的平衡常数Kh=_______(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10 mol·L-1 KOH溶液滴定 10.00 mL 0.10 mol·L-1 H2C2O4(二元弱酸)溶液所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和)。下列说法正确的是
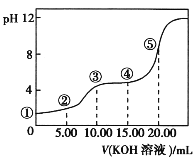
A.点①所示溶液中:![]() =1012
=1012
B.点②所示溶液中:c(K+)+c(H+)=c(HC2O4-)+c(C2O42-)+c(OH-)
C.点③所示溶液中:c(K+)>c(HC2O4-)>c(C2O42-)>c(H+)>c(OH-)
D.点④所示溶液中:c(K+)+c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.10 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学采用工业大理石(含有少量SiO2、Al2O3、Fe2O3等杂质)制取CaCl2·6H2O,设计了如下流程:
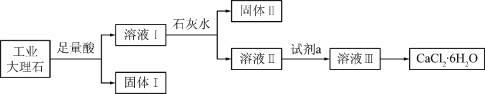
下列说法不正确的是
A. 固体I中含有SiO2,固体II中含有Fe(OH)3
B. 使用石灰水时,要控制pH,防止固体II中Al(OH)3转化为AlO2-
C. 试剂a选用盐酸,从溶液III得到CaCl2·6H2O产品的过程中,须控制条件防止其分解
D. 若改变实验方案,在溶液I中直接加氨水至沉淀完全,滤去沉淀,其溶液经蒸发浓缩、冷却结晶也可得到纯净CaCl2·6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在试管中先加入2 mL 95%的乙醇,并在摇动下缓缓加入2 mL浓硫酸,充分摇匀,冷却后再加入2 g无水醋酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上。在试管②中加入5 mL Na2CO3饱和溶液,按图示装置连接。用酒精灯对试管①加热,当观察到试管②中有明显现象时,停止实验。
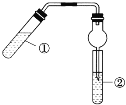
请回答下列问题:
(1)写出①中主要反应的化学方程式:______________。
(2)加入浓硫酸的目的是___________。
(3)试管②中观察到的现象是__________________。
(4)该实验中球形干燥管除起冷凝作用外,另一重要作用是_______,原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,探究铜与稀HNO3的反应过程如图:
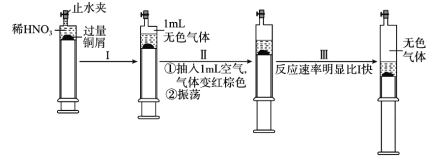
下列说法不正确的是( )
A.过程I中生成无色气体的离子方程式是3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O
B.步骤III反应速率比I快的原因是NO2溶于水,使c(HNO3)增大
C.由实验可知,NO2对该反应具有催化作用
D.当活塞不再移动时,打开止水夹,滴加稀硫酸,铜可以继续溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物A的红外光谱和核磁共振氢谱如图所示,下列说法中错误的是( )
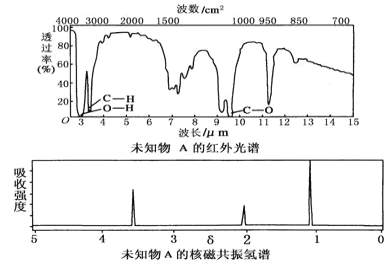
A.由红外光谱可知,该有机物中至少有三种不同的化学键
B.由核磁共振氢谱可知,该有机物分子中有三种不同化学环境的氢原子
C.仅由其核磁共振氢谱无法得知其分子中的氢原子总数
D.若A的化学式为C2H6O,则其结构简式为CH3—O—CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列化学用语的理解正确的是( )
A.比例模型![]() 既可以表示甲烷分子,也可以表示四氯化碳分子
既可以表示甲烷分子,也可以表示四氯化碳分子
B.电子式![]() 既可以表示羟基,也可以表示氢氧根离子
既可以表示羟基,也可以表示氢氧根离子
C.乙烷的最简式可表示为CH3
D.结构简式(CH3)2CHCH3既可以表示正丁烷,也可以表示异丁烷
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com