
【题目】常温下,HNO2的电离常数Ka=7.1×10-4,NH3·H2O的电离常数Kb=1.7×10-5。0.1 mol·L-1 NH4NO2溶液中,离子浓度由大到小的顺序是__________,常温下NO2-水解反应的平衡常数Kh=_______(保留两位有效数字)。
【答案】c(NO2-)>c(NH4+)>c(H+)>c(OH-) 1.4×10-11
【解析】
Ka>Kb,说明NH4NO2溶液中铵根离子的水解大于亚硝酸根离子的水解,则c(NO2-)>c(NH4+),溶液呈酸性,据此判断0.1 mol/LNH4NO2溶液中离子浓度由大到小的顺序;
NO2-水解的离子方程式为NO2-+H2O![]() HNO2+OH-,结合常温下NO2-水解反应的平衡常数K计算。
HNO2+OH-,结合常温下NO2-水解反应的平衡常数K计算。
常温下,HNO2 的电离常数Ka=7.1×10-4 molL-1,NH3H2O的电离常数Kb=1.7×10-5 molL-1,Ka>Kb,则NH4NO2溶液中铵根离子的水解大于亚硝酸根离子的水解,则c(NO2-)>c(NH4+),水解最终使溶液呈酸性,c(H+)>c(OH-),故0.1 molL-1NH4NO2溶液中离子浓度由大到小的顺序是:c(NO2-)>c(NH4+)>c(H+)>c(OH-);
NO2-水解的离子方程式为NO2-+H2O![]() HNO2+OH-,结合常温下NO2-水解反应的平衡常数Kh=
HNO2+OH-,结合常温下NO2-水解反应的平衡常数Kh=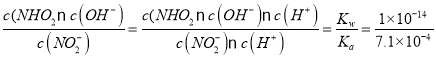 =1.4×10-11。
=1.4×10-11。


科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液能大量共存的是
A.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+
B.由水电离的c(H+)=1×10-14mol·L-1的溶液中:Ca2+、K+、Cl-、HCO3-
C.![]() =1012的溶液中:NH4+、Al3+、NO3-、Cl-
=1012的溶液中:NH4+、Al3+、NO3-、Cl-
D.c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO42-、SCN-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据媒体报道,法国一家公司 Tiamat 日前研发出比当前广泛使用的锂电池成本更低、寿命更长、充电速度更快的钠离子电池,预计从 2020 年开始实现工业生产。该电池的负极材料为 Na2Co2TeO6(制备原料为 Na2CO3、Co3O4和TeO2),电解液为 NaClO4 的碳酸丙烯酯溶液。 回答下列问题:
(1)Te 属于元素周期表中______区元素,其基态原子的价电子排布式为______。
(2)基态 Na 原子中,核外电子占据的原子轨道总数为______,最高能层电子云轮廓图形状为______。
(3)结合题中信息判断:C、O、Cl 的电负性由大到小的顺序为______ (用元素符号表示)。
(4)CO32-的几何构型为______;碳酸丙烯酯的结构简式如图所示,则其中碳原子的杂化轨道类型为______,1mol 碳酸丙烯酯中σ键的数目为______。
(5)[Co(H2O)6]3+的几何构型为正八面体形,配体是______,该配离子包含的作用力为______ (填选项字母)。
A.离子键 B.极性键 C.配位键 D.氢键 E.金属键
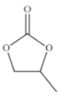
(6)Na 和 O 形成的离子化合物的晶胞结构如图所示,晶胞中 O 的配位数为______,该晶胞的密度为ρg/cm3,阿伏加德罗常数的值为 NA,则Na与O之间的最短距离为______cm(用 ρ、NA 的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铍铜是力学、化学综合性能良好的合金,广泛应用于制造高级弹性元件。以下是从某废旧铵铜元件(含BeO25%、CuS71%、少量FeS和SiO2)中回收铍和铜两种金属的流程。
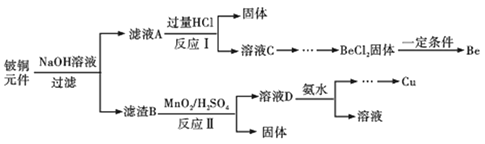
已知:
Ⅰ.铍、铝元素处于周期表中的对角线位置,化学性质相似
Ⅱ.常温下:Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mn(OH)2]=2.1×10-13
(1)滤渣B的主要成分为______(填化学式);
(2)写出反应Ⅰ中含铍化合物与过量盐酸反应的化学方程式______;
(3)MnO2能将金属硫化物中的硫元素氧化为单质硫,写出反应Ⅱ中CuS发生反应的离子方程式______,若用浓HNO3溶解金属硫化物缺点是______(任写一条);
(4)从BeCl2溶液中得到BeCl2固体的操作是______。
(5)溶液D中含c(Cu2+)=2.2molL-1、c(Fe3+)=0.008molL-1、c(Mn2+)=0.01molL-1,逐滴加入稀氨水调节pH可依次分离首先沉淀的是______(填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH大于______;
(6)取铍铜元件1000g,最终获得Be的质量为72g,则Be的产率是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物具有广泛的应用,间接碘量法可以测定铜合金中的铜,回答下列问题:
(1)铜合金的种类较多,主要有黄铜和各种青铜等。试样可以用HNO3分解,还需要用到浓H2SO4.CuSO4和Cu(NO3)2中阳离子的基态核外电子排布式为______;S、O、N三种元素的第一电离能由大到小的顺序为______;
(2)Cu(NO3)2溶液中通入足量NH3能生成配合物[Cu(NH3)4](NO3)2,其中NH3中心原子的杂化轨道类型为______,[Cu(NH3)4](NO3)2属于______晶体。
(3)CuSO4溶液中加入过量KCN能生成配离子[Cu(CN)4]2-,1 mol CN-中含有的π键数目为______,与CN-互为等电子体的离子有______(写出一种即可);
(4)CuSO4的熔点为560℃,Cu(NO3)2的熔点为115℃,CuSO4熔点更高的原因可能是______;
(5)在弱酸性溶液中,Cu2+与过量KI作用,生成CuI沉淀,同时析出定量的I2;如图为碘晶体晶胞结构。下列有关说法中正确的是______;
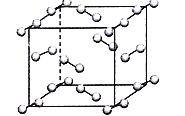
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子,以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中的碘原子间存在非极性键和范德华力
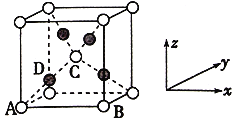
(6)已知Cu2O晶胞结构如图所示,该晶胞原子坐标参数A为(0,0,0),B为(1,0,0),C为(![]() )。则D原子的坐标参致为______,它代表______原子(填元素符号);已知金属铜的堆积方式是面心立方最密堆积,则晶体中铜原子的配位数是12,Cu原子的空间利用率是______。
)。则D原子的坐标参致为______,它代表______原子(填元素符号);已知金属铜的堆积方式是面心立方最密堆积,则晶体中铜原子的配位数是12,Cu原子的空间利用率是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,H2SO3HSO3-+H+的电离常数Ka=1×10-2,则该温度下NaHSO3的水解平衡常数Kh=____________,若向NaHSO3溶液中加入少量的I2,则溶液中![]() 将__________(填“增大”“减小”或“不变”)。
将__________(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,下列溶液的离子浓度关系式正确的是
A. pH=5的H2S溶液中,c(H+)= c(HS-)=1×10—5mol·L—1
B. pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C. pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+ c(H+)= c(OH-)+c( HC2O4-)
D. pH相同的①CH3COO Na②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,甘氨酸在水溶液中解离情况如下:H3N+CH2COOH(A+)![]() H3N+CH2COO-(A±)
H3N+CH2COO-(A±)![]() H2NCH2COO-(A-),改变溶液pH值,三种甘氨酸相关离子的分布分数(α,平衡时某物种的浓度占各物种浓度之和的分数)变化如图所示。当调节溶液的pH值使甘氨酸所带的净电荷为零,此时溶液的pH叫等电点。下列说法正确的是( )
H2NCH2COO-(A-),改变溶液pH值,三种甘氨酸相关离子的分布分数(α,平衡时某物种的浓度占各物种浓度之和的分数)变化如图所示。当调节溶液的pH值使甘氨酸所带的净电荷为零,此时溶液的pH叫等电点。下列说法正确的是( )
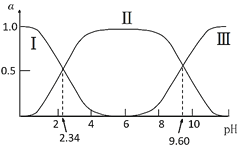
A.曲线Ⅰ、Ⅱ、Ⅲ分别代表的微粒为A、A±、A+
B.K2=102.34,且K2对应的解离基团为-NH3+
C.在pH=9.60的溶液中加盐酸,α(A±)+α(A+)+α(A)保持不变
D.甘氨酸的等电点pH约为6,且存在c(A±)=c(A+)=c(A)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素在周期表中的位置如图所示,其中只有M为金属元素。下列说法不正确的是( )
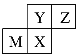
A.原子半径:Z<M
B.Y的最高价氧化物对应水化物的酸性比X的弱
C.X的最简单气态氢化物的热稳定性比Z的小
D.Z位于元素周期表中第二周期ⅤA族
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com