
【题目】25℃时,H2SO3HSO3-+H+的电离常数Ka=1×10-2,则该温度下NaHSO3的水解平衡常数Kh=____________,若向NaHSO3溶液中加入少量的I2,则溶液中![]() 将__________(填“增大”“减小”或“不变”)。
将__________(填“增大”“减小”或“不变”)。
科目:高中化学 来源: 题型:
【题目】已知水在25℃和95℃时,其电离平衡曲线如图所示:
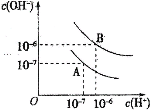
(1)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则pH=9的NaOH溶液与pH=4的H2SO4溶液的体积之比为______________。
(2)95℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是________________。
(3)95℃时,向Ba(OH)2溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH如表所示。
实验序号 | Ba(OH)2溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
① | 22.00 | 0.00 | 8 |
② | 22.00 | 18.00 | 7 |
③ | 22.00 | 22.00 | 6 |
假设溶液混合前后的体积不变,则a=_________,实验②所得溶液中由水电离产生的c(OH-)=______。
(4)95℃时,将0.1 mol·L-1的NaHSO4溶液与0.1 mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
甲 | 乙 | 丙 | 丁 | |
0.1 mol·/span>L-1 Ba(OH)2溶液体积/mL | 10 | 10 | 10 | 10 |
0.l mol·L-1 NaHSO4溶液体积/mL | 5 | 10 | 15 | 20 |
①按丁方式混合后,所得溶液显_____(填“酸”、“碱”或“中”)性。
②写出按乙方式混合后反应的化学方程式_______________________。所得溶液显______(填“酸”、“碱”或“中”)性。
③按甲方式混合,所得溶液的pH为________(混合时,忽略溶液体积的变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致现象的主要原因是液滴之下氧气含量比边缘处少。下列说法正确的是( )
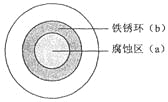
A.液滴中的Cl–由a区向b区迁移
B.液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-=4OH-
C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH形成Fe(OH)2,进一步氧化、脱水形成铁锈
D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为:Cu-2e-=Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用CoCO3为原料采用微波水热法和常规水热法均可制得H2O2分解的高效催化剂CoxNi(1-x)Fe2O4(其中Co、Ni均为+2价)。如图是用两种不同方法制得的CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线。下列说法不正确的是( )
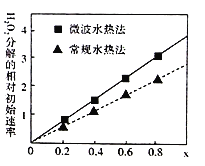
A.由图中信息,可知常规水热法制取的催化剂活性更高,Co2+的催化效果更好
B.微波协同CuO有利于H2O2除去氨态氮。该条件下,1molH2O2将NH3氧化为N2转移电子为2mol
C.常温下0.1moL/L氨水溶液的pH=a,将溶液稀释到原体积的10倍,不能使溶液pH=(a-1)
D.已知煅烧CoCO3时,温度不同,产物不同。在400℃充分煅烧CoCO3,得到固体氧化物的质量2.41g,CO2的体积为0.672L(标况下),则此时所得固体氧化物的化学式为Co3O4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,HNO2的电离常数Ka=7.1×10-4,NH3·H2O的电离常数Kb=1.7×10-5。0.1 mol·L-1 NH4NO2溶液中,离子浓度由大到小的顺序是__________,常温下NO2-水解反应的平衡常数Kh=_______(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有浓度均为![]() 的下列四种溶液:
的下列四种溶液:
①![]() 溶液 ②
溶液 ②![]() 溶液 ③
溶液 ③![]() 溶液 ④
溶液 ④![]() 溶液
溶液
(1)这四种溶液pH由大到小的顺序是______,其中由水电离的![]() 浓度最小的是______。(均填序号)
浓度最小的是______。(均填序号)
(2)②中各离子浓度由大到小的顺序是__________,![]() 的水解平衡常数
的水解平衡常数![]() ______
______![]() 。(已知碳酸的电离常数
。(已知碳酸的电离常数![]() )
)
(3)向③中通入少量氨气,此时 的值________(填“增大”、“减小”或“不变”)。
的值________(填“增大”、“减小”或“不变”)。
(4)若将③和④混合后溶液恰好呈中性,则混合前③的体积______④的体积(填“大于”、“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10 mol·L-1 KOH溶液滴定 10.00 mL 0.10 mol·L-1 H2C2O4(二元弱酸)溶液所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和)。下列说法正确的是
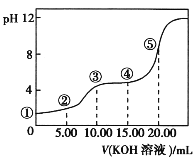
A.点①所示溶液中:![]() =1012
=1012
B.点②所示溶液中:c(K+)+c(H+)=c(HC2O4-)+c(C2O42-)+c(OH-)
C.点③所示溶液中:c(K+)>c(HC2O4-)>c(C2O42-)>c(H+)>c(OH-)
D.点④所示溶液中:c(K+)+c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.10 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在试管中先加入2 mL 95%的乙醇,并在摇动下缓缓加入2 mL浓硫酸,充分摇匀,冷却后再加入2 g无水醋酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上。在试管②中加入5 mL Na2CO3饱和溶液,按图示装置连接。用酒精灯对试管①加热,当观察到试管②中有明显现象时,停止实验。
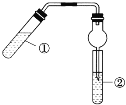
请回答下列问题:
(1)写出①中主要反应的化学方程式:______________。
(2)加入浓硫酸的目的是___________。
(3)试管②中观察到的现象是__________________。
(4)该实验中球形干燥管除起冷凝作用外,另一重要作用是_______,原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+3B2(g)2AB3(g)化学平衡状态的影响,得到如图所示的曲线(图中T表示温度,n表示物质的量)。下列判断正确的是( )
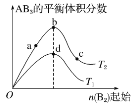
A.在T2和n(A2)不变时达到平衡,AB3的物质的量大小为c>b>a
B.若T2>T1,则正反应一定是放热反应
C.达到平衡时A2的转化率大小为b>a>c
D.若T2>T1,达到平衡时b、d点的反应速率为vd>vb
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com