
【题目】下列实验装置或操作设计正确且能达到目的的是( )
A.用CCl4提取碘水中的碘
B.冶炼金属Mg 
C.除去CO2中的HCl
D.蒸馏
科目:高中化学 来源: 题型:
【题目】臭氧(O3)在[Fe(H2O)6]2+催化下能将烟气中的SO2、NOx分别氧化为SO42-和NO3-,NOx也可在其他条件下被还原为N2。
(1)Fe3+基态核外电子排布式为__________________。
(2)与O3分子互为等电子体的一种阴离子为_____________(填化学式)。
(3)N2分子中σ键与π键的数目比n(σ)∶n(π)=__________________。
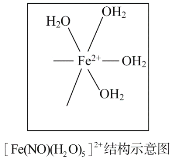
(4)[Fe(H2O)6]2+与NO反应生成的[Fe(NO)(H2O)5]2+中,NO以N原子与Fe2+形成配位键。请在[Fe(NO)(H2O)5]2+结构示意图的相应位置补填缺少的配体__________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4-CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
(1)CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g)。
已知:C(s)+2H2(g)=CH4(g) ΔH=-75 kJ·mol1
C(s)+O2(g)=CO2(g) ΔH=-394 kJ·mol1
C(s)+1/2O2(g)=CO(g) ΔH=-111 kJ·mol1
该催化重整反应的ΔH==______ kJ·mol1。有利于提高CH4平衡转化率的条件是____(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为_______mol2·L2。
(2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。
相关数据如下表:
积碳反应 CH4(g)=C(s)+2H2(g) | 消碳反应 CO2(g)+C(s)=2CO(g) | ||
ΔH/(kJ·mol1) | 75 | 172 | |
活化能/ (kJ·mol1) | 催化剂X | 33 | 91 |
催化剂Y | 43 | 72 | |
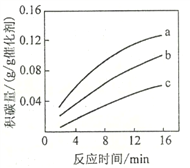
①由上表判断,催化剂X____Y(填“优于”或“劣于”),理由是_________________。在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如图所示。升高温度时,下列关于积碳反应、消碳反应的平衡常数(K)和速率(v)的叙述正确的是________填标号)。

A.K积、K消均增加 B.v积减小,v消增加
C.K积减小,K消增加 D.v消增加的倍数比v积增加的倍数大
②在一定温度下,测得某催化剂上沉积碳的生成速率方程为v=k·p(CH4)·[p(CO2)]-0.5(k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A~M有如图转化关系,A与F分子中含碳原子数相同,均能与NaHCO3溶液反应,且A中含一个卤素原子,F的分子式为C9H10O2;D能发生银镜反应;M与NaOH溶液反应后的产物,其苯环上一氯代物只有一种。

已知:![]() (R1、R2代表烃基或氢原子)
(R1、R2代表烃基或氢原子)
请回答:
(1)B、F的结构简式分别为__________、_________
(2)反应①~⑦中,属于消去反应的是_____________(填反应序号)。
(3)D发生银镜反应的化学方程式为______________;反应⑦的化学方程式为__________
(4)A的相对分子质量在180~260之间,从以上转化中不能确认A中含有哪种卤素原子,确定该官能团的实验步骤和现象为_____________
(5)符合下列条件F的同分异构体共有________种。
a.能发生银镜反应
b.能与FeCl3溶液发生显色反应
c.核磁共振氢谱上有四个峰,其峰面积之比为1∶1∶2∶6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取少量干燥的氨气,所用下列装置、药品等正确的是
A.①是氨气发生装置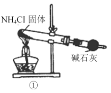 B.②是氨气发生装置
B.②是氨气发生装置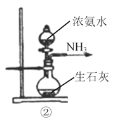
C.③是氨气收集、检验装置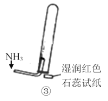 D.④是氨气吸收装置
D.④是氨气吸收装置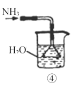
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质结构与性质自然界中存在大量的金属元素,其中钠、镁、铝、铁、铜等在工农业生产中有着广泛的应用。
(1)请写出Fe的基态原子核外电子排布式__________。
(2)金属A的原子只有3个电子层,其第一至第四电离能如下:

则A原子的价电子排布式为__________________。
(3)合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前常用醋酸二氨合铜(Ⅰ)溶液来吸收原料气体中的CO(Ac-代表CH3COO-),其反应是:[Cu(NH3)2]Ac+CO+NH3![]() [Cu(NH3)3CO]Ac ΔH<0。 配合物[Cu(NH3)3CO]Ac中心原子的配位数为__________。
[Cu(NH3)3CO]Ac ΔH<0。 配合物[Cu(NH3)3CO]Ac中心原子的配位数为__________。
(4)NaCl和MgO都属于离子化合物,NaCl的熔点为801.3 ℃,MgO的熔点高达2800 ℃。造成两种晶体熔点差距的主要原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)某研究小组用如图装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。
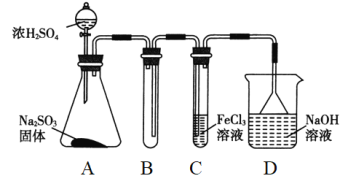
(1)通入足量SO2时C中观察到的现象是______________________。
(2)根据以上现象,该小组同学认为SO2与FeCl3溶液发生氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式:_______________________;
②请设计实验方案检验有Fe2+生成:_________________________;
③该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42-。该做法_____(填“合理”或“不合理”),理由是______。
(3)D装置中倒置漏斗的作用是__________________________。
(4)为了验证SO2具有还原性,实验中可以代替FeCl3的试剂有________(填字母)。
a.浓H2SO4 b.酸性KMnO4溶液 c.碘水 d.NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃A,相对分子质量为140,其中碳的质量分数为0.857。A分子中有两个碳原子不与氢直接相连。A在一定条件下氧化只生成G,G能使石蕊试液变红。

试写出:
(1)A的分子式___________________。
(2)化合物A和G的结构简式: A___________________,G___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com