
【题目】物质结构与性质自然界中存在大量的金属元素,其中钠、镁、铝、铁、铜等在工农业生产中有着广泛的应用。
(1)请写出Fe的基态原子核外电子排布式__________。
(2)金属A的原子只有3个电子层,其第一至第四电离能如下:

则A原子的价电子排布式为__________________。
(3)合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前常用醋酸二氨合铜(Ⅰ)溶液来吸收原料气体中的CO(Ac-代表CH3COO-),其反应是:[Cu(NH3)2]Ac+CO+NH3![]() [Cu(NH3)3CO]Ac ΔH<0。 配合物[Cu(NH3)3CO]Ac中心原子的配位数为__________。
[Cu(NH3)3CO]Ac ΔH<0。 配合物[Cu(NH3)3CO]Ac中心原子的配位数为__________。
(4)NaCl和MgO都属于离子化合物,NaCl的熔点为801.3 ℃,MgO的熔点高达2800 ℃。造成两种晶体熔点差距的主要原因是_____________。
【答案】[Ar]3d64s2 3s2 4 MgO晶体所含离子半径小,电荷数多,晶格能大
【解析】
(1)铁是26号元素,根据核外电子排布规律分析其基态原子核外电子排布式;
(2)从表中原子的第一至第四电离能可以看出,A的第二电离能小,第三电离能较大,说明易失去2个电子,则A的化合价为+2价;
(3)根据配合物[Cu(NH3)3CO]Ac结构进行分析;
(4)晶体所含离子半径小,电荷数多,晶格能大。
(1)铁是26号元素,根据核外电子排布规律,可知其基态原子核外电子排布式为:[Ar]3d64s2;
故答案是:[Ar]3d64s2;
(2)从表中原子的第一至第四电离能可以看出,A的第二电离能小,第三电离能较大,说明易失去2个电子,则A的化合价为+2价,应为Mg元素,价电子排布式为3s2;
故答案是:3s2;
(3)根据配合物[Cu(NH3)3CO]Ac可知:一价铜离子有三个氨基配体和一个羰基配体,共4个配体,配位数为4;
故答案是:4;
(4)MgO中离子都带2个单位电荷,NaCl中离子都带1个单位电荷,离子半径O2-<Cl-,Mg2+<Na+,高价化合物的晶格能远大于低价离子化合物的晶格能,晶格能:MgO>NaCl,故熔点:MgO>NaCl;
故答案是:MgO晶体所含离子半径小,电荷数多,晶格能大。


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】下列对分子性质的解释中,不正确的是( )
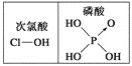
A. SO2易溶于水只是因为相似相溶原理
B. 乳酸(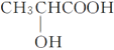 )分子中含有一个手性碳原子
)分子中含有一个手性碳原子
C. 碘易溶于四氯化碳,甲烷难溶于水都可用“相似相溶”原理解释
D. 由上图知酸性:H3PO4>HClO,因为H3PO4中非羟基氧原子数大于次氯酸中非羟基氧原子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质之间通过一步反应能实现如图所示转化关系,且与表中条件也匹配的是( )
选项 | X | Y | Z | 箭头上为反应条件或试剂 |
|
A | Fe | FeCl2 | FeCl3 | ①通入少量Cl2 | |
B | Na2CO3 | NaCl | NaHCO3 | ②先通CO2,再通过量NH3 | |
C | MgO | MgCl2 | Mg(OH)2 | ③加热 | |
D | NaAlO2 | Al(OH)3 | Al2O3 | ④加水 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在AgC1悬浊液中存在平衡: AgCl (s)![]() Ag+(aq)+Cl-(aq)。已知常温下,Ksp (AgCl)=1.6×10-10 (mol/L)2。下列叙述正确的是
Ag+(aq)+Cl-(aq)。已知常温下,Ksp (AgCl)=1.6×10-10 (mol/L)2。下列叙述正确的是
A. 常温下,AgCl 悬浊液中c (C1-)= 4×10-5.5mol/L
B. 温度不变时,向AgCl 悬浊液中加入少量NaCl 粉末,平衡向左移动,Ksp减小
C. 向AgCl悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明Ksp(AgCl) sp(AgBr)
D. 常温下,将0.001 mol·L-1AgNO3溶液与0.001 mol·L-1的KCl 溶液等体积混合,无沉淀析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Cu+HNO3 ———— Cu(NO3)2+NO↑+4H2O反应中,
(1) ______ 元素被氧化, ______ 是氧化剂;
(2) ______ 是氧化产物, ______ 发生氧化反应;
(3)被还原的HNO3与参加反应的HNO3物质的量之比是 ______;
(4)用双线桥标出该反应电子转移的方向和数目:
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O _____________________________________;
(5)当有8mol HNO3被还原时,反应转移___________个电子;
(6)写出该反应的离子反应方程式___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是

A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 上图所示实验可证明元素的非金属性:Cl>C>Si
D. 用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烟气中主要污染物为SO2、NO、NO2,可用如图工艺进行脱硫脱硝及产物回收。
(1)空气预处理过程中,发生主要反应的化学方程式为_______。
(2)洗气过程中,尿素作还原剂,转化成两种无污染的气体的化学式是_______
(3)充分曝气氧化过程中,发生反应的含镁化合物是_________。
(4)完成沉镁过程中生成碱式碳酸镁的离子方程式___Mg2++____= MgCO3Mg(OH)2↓+__CO2↑+____H2O
(5)(NH4)2SO4粗品中含有的主要杂质为_________(填名称)。
(6)碱式碳酸镁经过简单加工可循环利用,加工过程发生反应的化学方程式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com