
【题目】下列判断正确的是
A.Na2S2O3溶液中加入稀硫酸的离子方程式为:2S2O32-+4H+![]() SO42-+ 3S↓+ 2H2O
SO42-+ 3S↓+ 2H2O
B.用TiCl4制备TiO2的反应可表示为:TiCl4+(x+2)H2O(过量)![]() TiO2·xH2O↓+4HCl
TiO2·xH2O↓+4HCl
C.滴加甲基橙试液后呈红色的溶液中可以大量共存: Na+、 CO32-、 K+、 AlO2-
D.25℃时,pH=12的NaOH溶液中含有OH-的数目为0.01NA
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一种新型燃料电池,它是用两根金属做电极插入KOH溶液中,然后向两极上分别通甲烷和氧气,其电池反应为:X极:CH4+10OH-![]() 8e-=CO32-+7H2O ,Y极:4H2O+2O2+8e-=8OH-,下列关于此燃料电池的有关说法中错误的是( )
8e-=CO32-+7H2O ,Y极:4H2O+2O2+8e-=8OH-,下列关于此燃料电池的有关说法中错误的是( )
A. 通过甲烷的电极(X)为电池的负极,通过氧气的电极(Y)为电池正极
B. 放电一段时间后,电解质溶液中KOH的物质的量改变
C. 在标准状况下,通过5.6L氧气,完全反应后有1.0mol的电子发生转移
D. 放电时,通过甲烷的一极附近的pH升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铁粉和硫粉混合后加热,待反应一发生即停止加热,反应仍可持续进行,直至反应完全生成新物质。下列说法不正确的是( )
A.该反应是氧化还原反应
B.该反应的ΔH < 0
C.生成新物质的化学式为 Fe2S3
D.生成新物质的总能量低于反应物铁粉和硫粉的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠是一种高效氧化剂漂白剂,主要用于纸浆漂白、水处理等;工业上生产NaClO2有多种方法,某工业生产的流程如图所示:
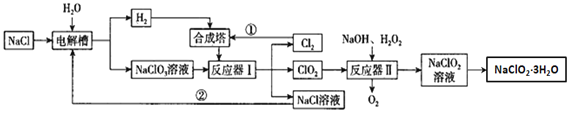
请回答下列问题:
(1)合成塔中生成的物质是___(填化学式);
(2)电解槽中阳极上的电极反应式为___;
(3)反应器Ⅰ中发生反应的化学方程式为___;反应器Ⅱ中发生的反应中氧化剂与还原剂物质的量之比为___;
(4)流程中①、②在工业生产中的现实意义是___;
(5)从NaClO2溶液中得到NaClO2·3H2O粗晶体的步骤为___、___,过滤、洗涤干燥;
(6)为了测定NaClO2·3H2O的纯度,取上述合成产品10g溶于水配成500mL溶液,取出10mL溶液于锥形瓶中,再加入足量酸化的KI溶液,充分反应后加入2~3滴淀粉溶液,用0.264mol/LNa2S2O3标准液滴定,锥形瓶中溶液___(填颜色变化),且半分钟内不发生变化,说明滴定达终点,用去标准液20.00mL,试样纯度是否合格___(填“合格”或“不合格”,合格纯度在90%以上)。提示:2Na2S2O3+I2=Na2S4O6+2NaI。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在![]() 时,碳酸钙在水中的沉淀溶解平衡曲线如图所示,已知
时,碳酸钙在水中的沉淀溶解平衡曲线如图所示,已知![]() 时硫酸钙的Ksp=9.1×10-6,下列说法正确的是( )
时硫酸钙的Ksp=9.1×10-6,下列说法正确的是( )
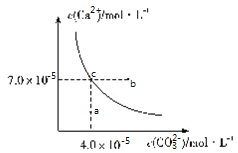
A.除去锅炉水垢中硫酸钙的办法是将其转化为碳酸钙,然后用酸去除
B.图中b点碳酸钙的结晶速率小于其溶解速率
C.通过蒸发,可使溶液由a点变化到c点
D.在25℃时,反应![]() 的平衡常数K=3500
的平衡常数K=3500
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应速率和限度的说法中,不正确的是
A. 实验室用H2O2分解制O2,加入MnO2后,反应速率明显加快
B. 在金属钠与足量水反应中,增加水的量能加快反应速率
C. 2SO2+O2![]() 2SO3反应中,SO2不能全部转化达为SO3
2SO3反应中,SO2不能全部转化达为SO3
D. 实验室用碳酸钙和盐酸反应制取CO2,若将块状碳酸钙粉碎,会加快反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液中的化学反应大多是离子反应。根据要求回答下列问题:
(1)盐碱地(含较多Na2CO3、NaCl)不利于植物生长,试用化学方程式表示:盐碱地产生碱性的原因:______________;农业上用石膏降低其碱性的反应原理:__________。
(2)若取pH、体积均相等的NaOH溶液和氨水分别用水稀释m倍、n倍,稀释后pH仍相等,则m________(填“>”“<”或“=”)n。
(3)常温下,在pH=6的CH3COOH与CH3COONa的混合溶液中水电离出来的c(OH-)=__________。
(4)25 ℃时,将a mol·L-1氨水与0.01 mol·L-1盐酸等体积混合,反应平衡时溶液中c(![]() )=c(Cl-),则溶液显________(填“酸”“碱”或“中”)性。用含a的代数式表示NH3·H2O的电离常数Kb=________。
)=c(Cl-),则溶液显________(填“酸”“碱”或“中”)性。用含a的代数式表示NH3·H2O的电离常数Kb=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在室温下,下列五种溶液:①0.1mol/L NH4Cl②0.1mol/L CH3COONH4 ③0.1mol/LNH4HSO4④0.1mol/L NH3H2O和0.1mol/L NH4Cl混合液 ⑤0.1mol/L NH3H2O。
请根据要求填写下列空白:
(1)溶液①呈_____性(填“酸”、“碱”或“中”),其原因是________(用离子方程式表示)。
(2)比较②③溶液中,c(NH4+)的大小关系是②______③(填“>”“<”或“=”)。
(3)在溶液④中,_____ 离子的浓度为0.1mol/L;NH3H2O和_____离子的物质的量浓度之和为0.2mol/L。
(4)室温下,测得溶液②的pH=7,则CH3COO-的水解程度_____(填“>”“<”或“=”)NH4+-的水解程度。CH3COO-与NH4+浓度的大小关系是:c(CH3COO-)_____c(NH4+)(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种气态烷烃和一种气态烯烃组成的混合物共20g,混合气体的密度是相同状况下氢气密度的12.5倍,让混合气体通过装有溴水的试剂瓶时,试剂瓶的质量增加了16.8 g,组成该混合气体的可能是( )
A.甲烷和乙烯B.乙烷和丙烯C.乙烷和乙烯D.甲烷和丙烯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com