
【题目】亚氯酸钠是一种高效氧化剂漂白剂,主要用于纸浆漂白、水处理等;工业上生产NaClO2有多种方法,某工业生产的流程如图所示:
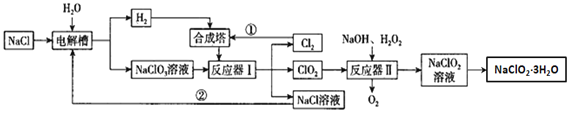
请回答下列问题:
(1)合成塔中生成的物质是___(填化学式);
(2)电解槽中阳极上的电极反应式为___;
(3)反应器Ⅰ中发生反应的化学方程式为___;反应器Ⅱ中发生的反应中氧化剂与还原剂物质的量之比为___;
(4)流程中①、②在工业生产中的现实意义是___;
(5)从NaClO2溶液中得到NaClO2·3H2O粗晶体的步骤为___、___,过滤、洗涤干燥;
(6)为了测定NaClO2·3H2O的纯度,取上述合成产品10g溶于水配成500mL溶液,取出10mL溶液于锥形瓶中,再加入足量酸化的KI溶液,充分反应后加入2~3滴淀粉溶液,用0.264mol/LNa2S2O3标准液滴定,锥形瓶中溶液___(填颜色变化),且半分钟内不发生变化,说明滴定达终点,用去标准液20.00mL,试样纯度是否合格___(填“合格”或“不合格”,合格纯度在90%以上)。提示:2Na2S2O3+I2=Na2S4O6+2NaI。
【答案】HCl Cl-+3H2O-6e-=ClO3-+6H+ 2NaClO3+4HCl=2NaCl+2ClO2↑+Cl2↑+2H2O 2:1 循环利用,提高原料利用率,降低生产成本 蒸发浓缩 冷却结晶 蓝色变为无色 合格
【解析】
NaCl溶液在电解槽中电解,生成氢气和NaClO3溶液,氢气和氯气在合成塔中化合成氯化氢。NaClO3溶液在反应器Ⅰ中和HCl发生反应生成氯气、二氧化氯和NaCl,NaCl和氯气可以循环使用。二氧化氯和NaOH以及过氧化氢在反应器Ⅱ中发生反应生成NaClO2。因为要从亚氯酸钠溶液中获取亚氯酸钠晶体,所以采取蒸发浓缩、冷却结晶、过滤、洗涤、干燥等步骤。
![]() 根据流程图可知,合成塔为氢气与氯气反应,生成HCl;故答案为:HCl;
根据流程图可知,合成塔为氢气与氯气反应,生成HCl;故答案为:HCl;
![]() 根据题意电解NaCl溶液得到氢气和
根据题意电解NaCl溶液得到氢气和![]() 溶液,阳极发生氧化反应,元素化合价升高,故阳极得到
溶液,阳极发生氧化反应,元素化合价升高,故阳极得到![]() 溶液,电极反应式为:
溶液,电极反应式为:![]() ;故答案为:
;故答案为:![]() ;
;
![]() 反应器Ⅰ中发生反应为HCl与
反应器Ⅰ中发生反应为HCl与![]() 溶液反应得到氯气、
溶液反应得到氯气、![]() 和NaCl,故反应为:
和NaCl,故反应为:![]() ;
;![]() 和NaOH、
和NaOH、![]() 在反应器II发生反应:
在反应器II发生反应:![]() ,氯元素化合价降低被还原,
,氯元素化合价降低被还原,![]() 为氧化剂,
为氧化剂,![]() 为还原剂,故氧化剂与还原剂物质的量之比为2:1;故答案为:
为还原剂,故氧化剂与还原剂物质的量之比为2:1;故答案为:![]() ;2:1;
;2:1;
![]() 流程中①、②是将得到的氯气和NaCl溶液循环利用,提高原料利用率,降低生产成本;故答案为:循环利用,提高原料利用率,降低生产成本;
流程中①、②是将得到的氯气和NaCl溶液循环利用,提高原料利用率,降低生产成本;故答案为:循环利用,提高原料利用率,降低生产成本;
![]() 从
从![]() 溶液中得到
溶液中得到![]() 粗晶体的步骤为蒸发浓缩、冷却结晶、过滤、洗涤、干燥;故答案为:蒸发浓缩;冷却结晶;
粗晶体的步骤为蒸发浓缩、冷却结晶、过滤、洗涤、干燥;故答案为:蒸发浓缩;冷却结晶;
![]() 取上述合成产品10g溶于水配成500mL溶液,取出10
取上述合成产品10g溶于水配成500mL溶液,取出10![]() 将KI氧化为碘单质,反应为:
将KI氧化为碘单质,反应为:![]() ,充分反应后加入
,充分反应后加入![]() 滴淀粉溶液,溶液显蓝色,用
滴淀粉溶液,溶液显蓝色,用![]()
![]() 标准液滴定,当碘反应完成,达到滴定终点,观察到溶液蓝色变为无色,且半分钟内不发生变化,根据关系式:
标准液滴定,当碘反应完成,达到滴定终点,观察到溶液蓝色变为无色,且半分钟内不发生变化,根据关系式:![]() ,则
,则![]() ,所以500mL溶液中含有:
,所以500mL溶液中含有:![]() ,则10g合成产品中含有:
,则10g合成产品中含有:![]() ,则
,则![]() ,所以产品合格;故答案为:蓝色变为无色;合格。
,所以产品合格;故答案为:蓝色变为无色;合格。


科目:高中化学 来源: 题型:
【题目】![]() 时,下列各溶液中有关微粒的物质的量浓度关系正确的是
时,下列各溶液中有关微粒的物质的量浓度关系正确的是![]()
![]()
A.向![]() 溶液中滴加NaOH溶液至恰好呈中性:
溶液中滴加NaOH溶液至恰好呈中性:![]()
B.![]() 溶液呈酸性:
溶液呈酸性:![]()
C.![]() 溶液与
溶液与![]() 溶液混合后的酸性溶液:
溶液混合后的酸性溶液:![]() COO
COO![]()
D.浓度均为![]() 的小苏打溶液与烧碱溶液等体积混合:
的小苏打溶液与烧碱溶液等体积混合:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向一定浓度的Na2X溶液中滴入盐酸,溶液的pH与离子浓度变化关系如图所示。

已知:H2X是二元弱酸,Y表示![]() 或
或![]() ,pY=﹣lgY.下列叙述不正确的是( )
,pY=﹣lgY.下列叙述不正确的是( )
A. 曲线n表示pH与p![]() 的变化关系
的变化关系
B. Ka2(H2X)=1.0×10﹣10.3
C. NaHX溶液中c(H+)>c(OH﹣)
D. 当溶液呈中性时,c(Na+)=c(HX﹣)+2c(X2﹣)+c(Cl﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiMn2O4是一种无污染、成本低的锂离子电池电极材料,某研究小组利用柠檬酸配合法制备LiMn2O4。
(1)按一定配比将醋酸锂(CH3COOLi)和醋酸锰[(CH3COO)2Mn]溶液混合后,加入柠檬酸(分子式C6H8O7)溶液中配成混料。用6 mol·L-1氨水调节pH至6.5~9,在75℃~85℃水浴中加热,制得柠檬酸配合物(其中Mn为+2价)。装置如图所示(加热和夹持装置已略去)。
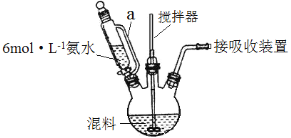
①滴液漏斗中a管的作用是________。
②实验室用14.8 mol·L-1浓氨水配制250 mL 6mol·L-1的氨水需要的仪器有胶头滴管、烧杯、玻璃棒、量筒、________。
③调节pH至6.5~9是为了促进柠檬酸电离。pH不能大于9的原因是______。
④用水浴加热的目的是__________。
(2)将制得的配合物在烘箱中真空干燥得到固态柠檬酸配合物前驱体,研磨后焙烧,得LiMn2O4。
①柠檬酸配合物前驱体应放在_______(填仪器名称)中焙烧。
②焙烧需要在空气中进行的原因是__________。
③焙烧产生的气体是________。
(3)测定产品中锰的含量:准确称取0.1000 g的产品试样,加入足量浓盐酸溶液加热溶解,驱赶溶液中残留的Cl2,配成250 mL溶液。取25.00 mL溶液于锥形瓶中用0.02000 mol·L-1EDTA(Mn2+与EDTA按1:1络合)滴定,消耗EDTA溶液的体积V mL。样品中锰的质量分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将0.1000mol·L-1的AgNO3标准溶液分别滴加到20mL浓度均为0.1000mol·L-1的NaCl和NaBr溶液中,混合溶液的pAg [-lgc(Ag+)]与滴定百分数(滴定所用标准溶液体积相对于滴定终点时所用标准溶液体积的百分数)的变化关系如图所示。下列叙述错误的是
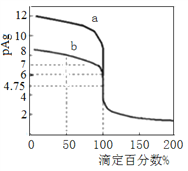
A. 曲线a代表滴定NaBr溶液
B. Ksp(AgCl) =1×10-9.5
C. 滴定至50%时,NaCl溶液中c(Na+) >c(NO3-)>c(Ag+)>c(H+)
D. 滴定至100%时,c(H+) +c(Ag+) = c(Br-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列判断正确的是
A.Na2S2O3溶液中加入稀硫酸的离子方程式为:2S2O32-+4H+![]() SO42-+ 3S↓+ 2H2O
SO42-+ 3S↓+ 2H2O
B.用TiCl4制备TiO2的反应可表示为:TiCl4+(x+2)H2O(过量)![]() TiO2·xH2O↓+4HCl
TiO2·xH2O↓+4HCl
C.滴加甲基橙试液后呈红色的溶液中可以大量共存: Na+、 CO32-、 K+、 AlO2-
D.25℃时,pH=12的NaOH溶液中含有OH-的数目为0.01NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某华人科学家和他的团队研发出“纸电池” (如图)。这种一面镀锌、一面镀二氧化锰的超薄电池在使用印刷与压层技术后,变成一张可任意裁剪大小的“电纸”,厚度仅为0.5毫米,可以任意弯曲和裁剪。纸内的离子“流过”水和氧化锌组成电解液,电池总反应式为: Zn+2MnO2+H2O=ZnO+2MnO(OH)。下列说法正确的是

A.该电池的正极材料为锌
B.该电池反应中二氧化锰发生了氧化反应
C.电池的正极反应式为2MnO2 +2H2O+2e-= 2MnO(OH)+2OH-
D.当有0.1mol锌溶解时,流经电解液的电子数为1.204×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.已知25℃,NH3·H2O的Kb=1.8×105,H2SO3的Ka1=1.3×102,Ka2=6.2×108。若氨水的浓度为2.0 mol·L1,溶液中的c(OH)=_______mol·L1,0.1 mol·L1的(NH4)2SO3溶液显______(填“酸性”、“碱性”或“中性”)。
Ⅱ. 某学生用0.200mol/L的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管,并注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下读数
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
请回答:
(1)以上步骤有错误的是______ (填编号)。
(2)滴定终点的现象为____________________________________________。
(3)用标准NaOH溶液滴定时,应将标准NaOH溶液注入______ 中(从图中选填“甲”或“乙”)。
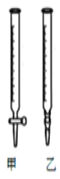
(4)下列操作会引起实验结果偏大的是______![]() 填编号
填编号![]() 。
。
A.在锥形瓶装液前,留有少量蒸馏水
B.滴定前,滴定管尖嘴有气泡,滴定后无气泡
C.滴定终点俯视读数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com